Infektív endocarditis
• Kardiológiai Szakmai Kollégium •
Írták: Bán Éva, Lengyel Mária (munkacsoport-vezető), Prinz Gyula
Bevezetés
Az infektív endocarditis (IE) diagnózisában és terápiájában a klinikai gyakorlat tapasztalataira támaszkodó javaslatokat tehetünk, ennél a betegségnél - a kórkép természetéből adódóan - nagy, kontrollált vizsgálatok nincsenek. Az ajánlások tehát a nagy tapasztalatú szakemberek konszenzusán alapulnak, melyeknek a szintjét C-vel jelöljük.
Az irodalomkutatásban a témában megjelent legfontosabb nemzetközi és hazai ajánlásokat (1-8) és a Medline adatbázisát vettük figyelembe.
Definíciók
Infektív endocarditis: a cardiovascularis struktúrák endothelialis felszínén és az intracardialis idegen testek felszínén létrejövő mikrobás infekció. Jellemző megjelenési formája a vegetáció, de lehet intramyocardialis lokalizáció is.
Az endovascularis infekciók helyes elnevezése endocarditis lenne, mégis az IE-hez soroljuk őket (nyitott Botallo-vezeték, coarctatio stb.) (1).
Nem használjuk a bakteriális endocarditis és az endocarditis lenta, valamint az akut és szubakut IE elnevezést sem.
Az IE definiálható az érintett billentyű, a kórokozó, az érintett populáció és az IE stádiuma szerint is.
Natív billentyű IE-ben (NBIE) megkülönböztethetünk bal és jobb szívfél IE-t.
Műbillentyű IE (MBIE) lehet korai (a műtét utáni 12 hónapon belül kialakuló) és késői (1, 9, 10).
A kórokozó szerint beszélhetünk Staphylococcus, Enterococcus, Streptococcus, Gram-negatív vagy gomba IE-ről, továbbá negatív hemokultúrájú IE-ről.
Az érintett populáció alapján van gyermek-, időskori IE, kábítószer-élvezők IE-je. Időskori IE-ről 70 év felett beszélünk (11).
Nosocomialis az IE, ha kórházi keletkezésű, a felvételtől számított 72 óra után, az azt követő 6 hónapon belül lép fel, és valamilyen műszeres beavatkozáshoz, intenzív osztályi kezeléshez köthető (12). Idetartozik a korai MBIE is.
Pacemaker (PM) IE a zsebből vagy az elektródáról indul ki, lehet korai vagy késői (13).
Aktív IE főleg a műtétre kerülő betegeknél fontos meghatározás. Definíciója: lázas, szeptikus állapot és/vagy pozitív hemokultúra, műtétnél eltávolított szövetek pozitív tenyésztése, gyulladásos eltérések észlelése a műtét során, illetve az előtt 2 hónapon belül felállított diagnózis (14,15).
Recidív IE: a korábbi IE gyógyulása vagy a műtét után több mint egy évvel fellépő IE.
Definitív vagy lehetséges IE: lásd Duke-kritériumok.
Epidemiológia, prognózis
Az IE diagnózisára és kezelésére vonatkozó irányelvek fontosságát alátámasztja egyfelől az IE fokozódó gyakorisága, másfelől a mintegy 20 éve változatlanul kedvezőtlen prognózis (16). Ez utóbbi oka részben a diagnosztikus késés, részben az inadekvát kezelés. Ugyanakkor kérdéses, hogy a prevenció javításával a gyakoriság csökkenthető-e.
Az IE incidenciája országonként különböző, az eltérő diagnosztikus kritériumoknak megfelelően. Hazai felmérés nincs. A nemzetközi adatok alapján 2-12/100 000 lakos/év az incidencia, de 70 éven felül ez a szám 24, kábítószer-élvezőknél pedig 100 körüli (1). A MBIE incidenciája 1%/betegév (10).
Az IE halálozása 16-33%, nosocomialis IE-ben akár 60%, korai MBIE-ben 80% is lehet (1, 2).
Diagnózis
Az IE klinikai diagnózisa gyakran nehéz az aspecifikus tünetek (elhúzódó vagy visszatérő láz, deréktáji fájdalom, fogyás) miatt. A legfontosabb a gyanú korai felvetése (2).
IE gyanúját keltik a következő kombinációk:
- billentyűhiba + ismeretlen eredetű láz;
- új regurgitatiós zörej + láz;
- láz + embólia;
- műbillentyű + legalább egy hete fennálló láz;
- műbillentyű-diszfunkció + láz;
- fentiek bármely további kombinációja.
Klinikai szindróma
A leggyakoribb tünet a láz, melyhez általános tünetek (fáradékonyság, fogyás) csatlakoznak. Az esetek 90%-ában észlelhető szívzörej. Új zörej azonban csak 30-40%-ban alakul ki, ezek jellegzetesen regurgitatiós zörejek (18).
A szívelégtelenség a leggyakoribb szövődmény (40-60%-ban van), ezt követi az embolisatio (20-40%). Az embóliák fele cerebrális, ezért gyakori az IE első jeleként fellépő stroke láz kíséretében.
A klasszikus bőrjelenségek, vascularis laesiók ma már csak az esetek 5-20%-ában láthatók. Leggyakoribb a petechia, de az Osler-csomó (fájdalmas szubkután csomó az ujjakon, a tenyéren), a Janeway-laesio (fájdalom nélküli piros foltok a tenyéren és a talpon) és a Roth-foltok (retinabevérzés) ritka, de diagnosztikus értékű jelek.
A dobverőujj régóta fennálló IE-re jellemző. A splenomegalia az antibiotikus érában megszűnt jellemző tünet lenni, az esetek 20%-ában írják le (19). A lépabscessus (2%) a lépinfarktus (embólia) következménye, ultrahanggal vagy CT-vel diagnosztizálható. Meglepően gyakoriak és diagnosztikus tévedésre vezetnek a musculosceletalis manifesztációk (40%): arthralgia, myalgia, lumbágó. Ezek a tünetek antibiotikus kezelésre jellemzően prompt megszűnnek.
A pulmonalis tünetek (multiplex embóliás szórás, esetleg cavumképződés is) a jobb szívfél IE gyakorlatilag minden esetében megtalálhatók. Veseérintettség (haematuria, proteinuria) csaknem minden esetben van, de veseelégtelenség csak 10-33%-ban fordul elő.
A mikotikus aneurizma az egyik leggyakoribb szövődmény, az IE-esetek 5-10%-ában írták le (19). Nevével ellentétben nem gombás eredetű, hanem az artériák vasa vasorumának embolisatiója okozza az artériafal elvékonyodását. Az intracranialis mikotikus aneurizma ritka (1-5%), de extrém módon veszélyes, főleg a ruptura miatt, melynek mortalitása 80%, és a ruptura bekövetkezéséig gyakran tünetmentes (18). A szövődmények közül a paravalvularis extenzió következtében atrioventricularis blokk alakulhat ki, mely akár pacemakerbeültetést is szükségessé tehet, műbillentyű paravalvularis leak pedig súlyos haemolyticus anaemiát okozhat.
Laboratóriumi tünetek
Gyakori az anémia (70-90%), a gyorsult süllyedés (90%), az igen magas CRP, a proteinuria (50-65%). A leukocytosis nem jellemző (20-30%). A 6 hétnél hosszabb lefolyás esetén gyakori a pozitív reumatoid faktor (40-50%) (19).
Diagnosztikus kritériumok
A gyanú igazolására diagnosztikus módszerekre van szükség. Ezek alkalmazására épül a Duke-kritériumok rendszere, melyet bizonyos módosításokkal, kiegészítésekkel használunk (1-3. táblázat). Lényege, hogy a patológiai kritériumon kívül olyan major klinikai kritériumot is tartalmaz, mely az in vivo, echokardiográfiával kimutatható „patológiai” eltéréseket jelenti (3).
Kiegészítések a Duke-kritériumokhoz: (17)
- negatív hemokultúra esetén: szerológia Q-láz kimutatására;
- magas CRP (100 mg/ml felett) megerősíti a gyanút;
- újonnan kialakult dobverőujj legalább 2 hónapja fennálló IE-re utal;
- a multiplan transoesophagealis echokardiográfia (TEE) külön említendő az echokardiográfiás érintettség bizonyítására.
Mikrobiológiai diagnózis
Az IE mikrobiológiai diagnosztikájában kitüntetett szerepe van a hemokultúráknak, de a kórokozót fertőzött embolus, szeptikus szórásból származó minta, eltávolított billentyű és fertőzött idegen anyag (pacemakerelektróda, kanülvég stb.) feldolgozása során is izolálni lehet.
Hemokultúra
A vérvételek gyakorisága
Az infektív endocarditis major kritériumai közé tartozik a hemokultúra „valódi” pozitivitása. A valódi pozitivitás bizonyítékai a következők:
- Az endocarditisre jellemző tipikus kórokozó kitenyésztése két különböző hemokultúrából (nem egy időben levett vér két különböző palackjából!).
- A bacteriaemia perzisztenciájának a bizonyítása: endocarditisben előforduló mikroorganizmus kitenyésztése három, egymás után levett olyan hemokultúra mindegyikében, amely széria első és utolsó vérvétele között legkevesebb egy óra telt el (7, 8).
A vérvétel ideje
Infektív endocarditisben a bacteriaemia folyamatos, ezért nem szükséges, hogy a vérvételek a láz emelkedésével egy időben történjenek.
Hemokultúrát lehetőség szerint 24-48 órás antibiotikum-szünetben vegyünk. Hosszan tartó előzetes antibiotikum-kezelés, az adagolás abbahagyása után akár 6-7 napig is gátolhatja a baktérium kitenyésztését.
A vérvétel módja
A kontamináció és a klinikailag szignifikáns kórokozó elkülönítésének nehézségei miatt a vérvétel a maximális sterilitás betartásával történjen különböző vénákból (intravascularis katéteren keresztül vett vérminta vizsgálata kerülendő). A szúrás helyének effektív fertőtlenítése ajánlott. A vacutaineres és ahhoz hasonló vérvételi szerelékek használata csökkenti a kontamináció veszélyét.
A levett vér mennyisége
Mivel a vérben a baktériumszám igen alacsony (esetleg kevesebb mint egy csíra milliliterenként), célszerű minél több vérmennyiséget tenyészteni. Egy hemokultúra vétele alkalmával a dupla palackra kalkulálva felnőtt betegnél minimálisan 10, optimálisan 20 ml vért tenyésztünk.
A hemokultúrás palack
Mivel az infektív endocarditisben az anaerob baktériumok szerepe elhanyagolható, a vért általában két, ún. aerob palackba osztjuk. Anaerob kórokozó alapos gyanúja esetén a második palack természetesen ún. „anaerob” palack legyen. Speciális esetben (pl. mycobacterium gyanújakor) az arra rendeltetett speciális palackok használata ajánlott.
A palackok tárolása
A beoltatlan palackokat tárolhatjuk +4 °C-on vagy szobahőn, a vér csak 37 °C-ra vagy esetleg szobahőmérsékletre felmelegített palackba kerülhet! A beoltott palackok termosztátba kerülés előtt 1-2 napig is tárolhatók szobahőmérsékleten.
A hemokultúrás palackok inkubálása
Az inkubálási idő 5-7 nap. A hemokultúra negativitása, de az infektív endocarditis alapos gyanúja esetén az inkubációt 14 napra vagy annál hosszabb időre meghosszabbíthatjuk. A növekedés jelzésekor a szubkultúra elkészülése előtt a laboratórium a mikroszkópos vizsgálat alapján előzetes eredményt adhat.
Kontroll-hemokultúra
A hemokultúra pozitivitását követő antibiotikum-kezelés alatti ún. kontroll-hemokultúrák vizsgálatának nagyon kicsi az érzékenysége, ezért végzésük csak a klinikai válasz elmaradása vagy relapsus esetén ajánlott.
A kórokozó baktérium izolálása, identifikálása
Az izolált baktérium identifikálását species szintig kell elvégezni.
- Az infektív endocarditisben típusosan előforduló baktériumok: alfa-hemolizáló Streptococcusok, Streptococcus bovis, Staphylococcus aureus, Enterococcus spp., HACEK csoport (Haemophilus spp. Actinobacillus, Cardiobacterium Eikenella, Kingella), abiotrófia.
- Előfordulnak még: Gram-negatív pálcák (mint pl. a Salmonella), koaguláz-negatív Staphylococcus, gombák. A kórokozók gyakoriságát NBIE-ben és MBIE-ben a 4. táblázat foglalja össze (11). NBIE-ben a leggyakoribb mikroorganizmusok a Streptococcusok. S. bovis esetén vastagbélfolyamatra kell gondolni, epe- és húgyúti beavatkozások után elsősorban Enterococcus jön szóba. Koaguláz-negatív Staphylococcusok ritkán okoznak NBIE-t, MBIE-ben viszont jelentős szerepük van (7, 8). Intravénás kábítószer-élvezők IE-jét elsősorban S. aureus okozza, de Pseudomonas és Candida is előfordul.
A negatív hemokultúrájú endocarditis
A klinikailag IE-nek gyanítható esetek mintegy 5%-ában a szokványosan elvégzett vértenyésztések negatívak. Ezek mögött az előzetes antibiotikus kezelés vagy a következő etiológia állhat: Brucella, Bartonella, Legionella, mycobacterium, Nocardia, gomba, Coxiella burnetii, Chlamydia. Az etiológai tisztázása speciális tenyésztéseket (pl. a szokványos hemokultúra helyett líziscentrifugálást) és egyes esetekben (Bartonella, Brucella, Legionella, Coxiella, Chlamydia) szerológiai vizsgálatokat igényel (18,20).
Az izolált baktériummal végzett antibiotikum-érzékenységi vizsgálatok
A szemikvantitatív korongdiffúziós érzékenységi vizsgálat screenelő tesztként elégséges a legtöbb nem komplikált, az infektív endocarditisben típusos baktériumok érzékeny egyedei által okozott esetekben. Ugyanakkor kvantitatív vizsgálat (MIC-meghatározás) indokolt a következő baktérium/antibiotikum pár esetén:
- Bármely törzs esetében felmerülhet a penicillin, ampicillin, vancomycin (vagy teicoplanin), aminoglikozid, rifampicin és quinolon MIC-meghatározása.
- Alfa-hemolizáló Streptococcus/penicillin (esetleg ampicillin vagy ceftriaxon), ha a törzs a fenti antibiotikumok iránt korongdiffúziós vizsgálattal nem tűnik egyértelműen érzékenynek.
- Enterococcus sp./aminoglikozid. Amennyiben az izolált Enterococcus korongdiffúziós módszerrel gentamicinnel szemben magas fokban rezisztensnek tűnik, gentamicin, ill. streptomycin MIC-meghatározás indokolt.
- Staphylococcus aureus, ill. koaguláz-negatív Staphylococcus oxacillin MIC-meghatározás, amennyiben a törzs korongdiffúziós módszerrel nem tűnik egyértelműen oxacillinérzékenynek.
- A HACEK csoport esetében a penicillin MIC-meghatározást a béta-laktamáz enzim kimutatása helyettesíti.
- Enterococcus (ritkán Staphylococcus sp.) esetén vancomycin, ill. teicoplanin MIC-meghatározás szükséges.
Minimális baktericid koncentráció meghatározása
Rutinvizsgálatként nem ajánlott, elvégzése egyes esetekben, különösen olyan izolátumok esetén, amelyek az ún. „tolerancia” jelentőségét mutatják, indokolt lehet.
Az antibiotikum-kombináció szinergén hatását kimutató vizsgálat
Rutinvizsgálatként nem ajánlott. Elvégzése indokolt lehet olyan, viszonylag ritka izolátumok esetén, amelyekre vonatkozóan még nincs nagyszámú kezelési tapasztalat (pl. Lactobacillus sp. által okozott infektív endocarditis).
Szérumbaktericid teszt
Az in vivo viszonyokat jól tükrözi az in vitro vizsgálat, de mivel nincs kellőképpen standardizálva, a rutindiagnosztikában nem ajánlott. Ugyanakkor egyes, kezelésre nem jól reagáló esetekben a vizsgálat eredménye hasznos információt adhat.
Echokardiográfia
Major Duke-kritériumot jelentő echokardiográfiás ismérvek: a vegetáció, az abscessus és a periprostheticus dehiscentia.
További strukturális szövődmények: pseudoaneurysma, fenesztráció, fisztula, billentyűruptura, ínhúrruptura.
Definíciók
Vegetáció: a billentyűhöz csatlakozó mobilis echótömeg. Az atrioventricularis billentyűk pitvari felszínén, ínhúrokon, az aortabillentyű bármely felszínén, műbillentyűkereten, idegen testen, ritkán a fali endocardiumon helyezkedik el.
Abscessus: nem pulzatilis, echómentes vagy echóval kitöltött, esetleg rekeszes paravalvularis üreg, főleg paraaorticus elhelyezkedésű (21).
Pseudoaneurysma: pulzatilis, echómentes, az aorticomitralis kontinuitásban elhelyezkedő üreg, melynek rupturája fisztulát okozhat, vagy a pericardiumzsákba törhet be, tamponádot okozva (22).
Fenesztráció: a billentyűszövet folytonossági hiánya (23).
Doppler-echokardiográfiával mutatjuk ki az IE hemodinamikai következményeit. A billentyűdestrukció következménye az akut regurgitatio, MBIE-ben az akut paravalvularis regurgitatio, ritkán fisztulák vagy nagy vegetáció okozta obstrukció (főleg MBIE-ben). Ezek a következmények balkamra-diszfunkcióhoz, pulmonalis hipertóniához, hemodinamikai katasztrófához vezetnek.
A transthoracalis echokardiográfia (TTE)
Alkalmas az NBIE-vegetációk ábrázolására a korábban ép billentyűkön és a rupturák, továbbá a hemodinamikai következmények kimutatására. A TTE diagnosztikus értéke korlátozott a paravalvularis üregek tekintetében, és nem alkalmas az MBIE diagnosztikájára.
A transoesophagealis echokardiográfia (TEE)
A TEE szenzitivitása lokalizációtól függetlenül közel 100% NBIE-ben és MBIE-ben, míg a TTE érzékenysége mindössze 50, ill. 20-25%. A két módszer specificitása ugyanakkor egyaránt magas mindkét típusban (24, 25). Különösen értékes a TEE a korábban beteg (szklerotikus, prolapsusos, reumás) billentyűk esetén és az idősek IE-jében (26), továbbá negatív hemokultúra esetén, főleg magas rizikójú betegeknél (nagy vegetáció, MBIE) és a paravalvularis üregek (abscessusok, pseudoaneurysmák) kimutatásában (27, 28, 29), valamint az IE további lokális szövődményeinek (fenesztráció, aneurizma) ábrázolásában (21, 23, 28). Jobb szívfél NBIE-ben a TEE nem jelent előnyt a TTE-hez képest, de az idegen testek (pacemaker-, ill. ICD-elektródák, kanülök), vegetációinak kimutatásához TEE-re van szükség (30, 31).
Nosocomialis IE-ben és kórházi eredetű Staphylococcus aureus bacteriaemiában az IE igazolására és kizárására a TEE a megbízható és költséghatékony módszer (32).
A TTE és TEE az embóliaveszély megítélésében
Az IE leggyakoribb perifériás szövődménye az embólia: balszívfél-endocarditisben 30-40%-ban fordul elő, és az esetek több mint fele stroke formájában jelentkezik. Az embóliaveszély rizikófaktorai közé tartozik a baktérium típusa, a fertőzés aktivitása és vegetációk morfológiája és lokalizációja.
Egy 10 tanulmányt feldolgozó metaanalízis szerint a 10 mm-nél nagyobb vegetáció egyértelmű embóliaveszélyt jelent (33), de a 3 TEE-s tanulmány közül csak egy igazolta ezt a tételt (34) natív billentyűkre és mitralis pozícióra korlátozva. Mások sem a vegetáció méretével, sem mobilitásával, sem változásával nem tudtak összefüggést kimutatni (35, 36), vagy esetleg csak a vegetáció növekedésével (37).
A legfontosabb támpontot az infekció aktivitása nyújtja: az embóliarizikó meredeken csökken az adekvát és hatékony antibiotikus kezelés 1-2. hetében (38). Saját prospektív TEE-tanulmányunkban csak azok a betegek kaptak embóliát, akik az antibiotikus kezelés első hetében voltak, és a vegetáció mérete ≥15 mm volt, a lokalizációtól, mobilitástól és baktériumtól függetlenül (39).
A TEE szerepe az IE műtéti kezelésében
Műtéti indikációk
A TEE-lelet önmagában abszolút műtéti indikációt képez a következő esetekben:
- perivalvularis abscessus vagy pseudoaneurysma;
- fisztula;
- új periprostheticus leak.
Relatív indikációt jelent a TEE-vel kimutatott nagyméretű (10-15 mm-nél nagyobb) balszívfél-billentyűvegetáció, az adekvát antibiotikus kezelés megkezdése előtt vagy annak első hetében.
Műtéti terv
A műtéti terv szempontjából lényeges információt jelent a TEE a következő esetekben:
- a fenesztráció, ill. aneruizmabejárat zárása folttal;
- a vegetectomia lehetősége, főleg tricuspidalis billentyű IE-ben;
- billentyűplasztika lehetősége, főleg hátsó mitralis vitorla-ínhúrruptura esetén;
- a mitralis billentyű intraoperatív megtekintésének fontossága „kissing” vegetáció vagy jet laesio esetén aorta NBIE-ben.
Intraoperatív TEE a következő esetekben indokolt:
- vegetectomia;
- billentyűplasztika;
- rekonstrukciós műtét pseudoaneurysma és fisztula miatt.
A TEE korlátjai
A TEE nem alkalmas vagy bizonytalan a gyógyult és aktív vegetáció elkülönítésére, a műbillentyű-vegetáció és thrombus, a billentyűvegetáció és tumor, továbbá a bakteriális és nem bakteriális trombotikus vegetáció (szisztémás lupus, malignitas, antifoszfolipid-szindróma) elkülönítésére.
A TEE szenzitivitása alacsony a 2 mm-nél kisebb vegetációk felismerésében, így Q-láz IE-ben is (18).
A negatív TEE jelentősége
A TEE magas szenzitivitású, de többnyire nem éri el a 100%-ot. A TEE negatív prediktív értéke NBIE-ben 95% (25), MBIE-ben 90% (25), abscessusra 92% (28). Tehát alapos klinikai gyanú esetén a negatív TEE nem alkalmas az IE kizárására (40). Ilyen esetben javasolt a TEE ismétlése 7-10 nap múlva: az ekkor is biztonsággal negatív TEE kizárja az IE-t (40). Fontos azonban tisztában lennünk azzal, hogy az echokardiográfia, így a TEE is, vizsgálófüggő módszer, függ a vizsgálónak konkrétan az IE különböző formáiban szerzett tapasztalatától.
Ajánlás (C szint)
Az echokardiográfia indikációi
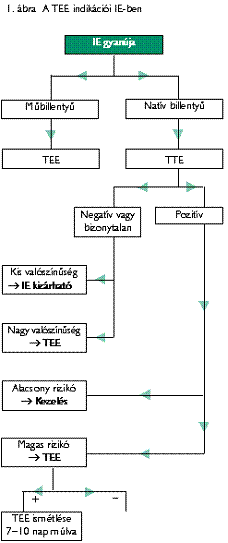
Klinikai gyanú esetén echokardiográfia indikált a hemokultúra levételével egyidejűen. Az MBIE rossz prognózisa miatt kiemelt fontosságú a korai diagnózis, akár korai (posztoperatív, 1 éven belül), akár késői MBIE-ről van szó. A TEE indikációit az algoritmus szemlélteti (1. ábra). Jóllehet a TEE diagnosztikus értéke felülmúlja a TTE-ét, mégsem minden esetben indikált, és főleg nem első vizsgálatként. A TTE az infekciós elváltozásokon kívül számos fontos információval egészíti ki a megítélést, tehát a TTE és TEE kombinációját kell alkalmazni.
A TEE első lépésként indikált MBIE gyanúja esetén.
Negatív vagy bizonytalan TTE eredménye esetén akkor indikált a TEE, ha a klinikai gyanú közepes vagy magas fokú. Közepes fokú a gyanú, ha 1 vagy 2 minor Duke-kritérium, magas fokú, ha legalább 3 minor Duke-kritérium áll fenn. Pozitív hemokultúra esetén az IE valószínűsége 20%, ha ehhez prediszponáló szívbetegség társul, akkor több mint 50%, új regurgitatiós zörej esetén 100% (41, 42).
Pozitív TTE és magas klinikai rizikó esetén is TEE javasolt.
Magas rizikót jelentő tényezők:
- műbillentyű,
- aortalokalizáció,
- Staphylococcus-, gombainfekció,
- elégtelen válasz az antibiotikus kezelésre,
- elhúzódó klinikai lefolyás.
Staphylococcus bacteriaemiában akkor javasolt a TEE, ha 2 hetes antibiotikus kezelés után a TTE negatív, tehát a TEE alapján dönthető el az IE fennállása, mely további antibiotikus kezelést tesz szükségessé (32).
A TEE ismétlésének indikációi
- Egyértelmű indikációk (18):
- magas klinikai valószínűség és negatív TEE;
- pozitív TEE, de további klinikai progresszió, szövődmények, magas rizikó.
- Kérdéses indikációk:
- a prognózis, gyógyulás szempontjából a vegetáció méretének, változásának megítélése;
- közvetlenül műtét előtt.
- Nincs indikáció (43):
Kezelés
Antibiotikus kezelés
Elvek
Az antibiotikus kezelés legyen célzott, baktericid, parenteralis, és kövesse a standard adagolás ajánlásait (1).
Kezdeti kezelés
Az antibiotikus kezelés megkezdését a beteg klinikai állapota, rizikója szabja meg. Alacsony rizikójú, stabil betegeknél a célzott kezelés megkezdése halasztható az első hemokultúrák megérkezéséig, különösen, ha a beteg az utolsó 8 napban antibiotikus kezelésben részesült, mert ilyenkor újabb hemokultúra-vételre lehet szükség. Magas rizikójú betegeknél viszont 3 hemokultúra levétele után rögtön empirikus terápiát kell kezdeni.
Célzott kezelés
A hemokultúra eredménye alapján a nemzetközi ajánlásoknak (1, 4) megfelelő sémákat használjunk a kórokozók szerint (5-11. táblázat). Streptococcus NBIE kezelése függ a MIC-értéktől (5., 6. táblázat), érzékeny Streptococcusok (MIC≤0,1 mg/l) kezelésére választhatunk a 4 és a 2 hetes séma között. Ha a MIC 0,1-0,5 mg/l közé esik, a penicillint 4 hétig kell adni, az első 2 hétben gentamicinnel kombinálva.
A magas rezisztenciájú (MIC>0,5 mg/l) Streptococcusok kezelésére az Enterococcus adagolási sémája ajánlható, mely szerint Penicillin G vagy ampicillin és gentamicin kombináció között választhatunk (7. táblázat).
A penicillinrezisztens törzsek esetén vancomycin + gentamicin kombináció ajánlatos, a penicillinallergiás betegek kezeléséhez hasonlóan. A methicillinérzékeny S. aureus (MSSA) esetén oxacillin az első választás. A methicillinrezisztens Staphylococcus aureus (MRSA) általában aminoglikozid-rezisztenciát is mutat (1), ezért nem javasolják a vancomycin kiegészítését gentamicinnel NBIE esetén (8. táblázat). A koaguláz-negatív Staphylococcusokra hasonló elvek vonatkoznak.
MBIE vagy más idegen testeken kialakuló IE magas mortalitású betegség, ezért ajánlatos az oxacillin- vagy methicillinrezisztens törzsek esetén a vancomycin kiegészítése rifampicinnel és gentamicinnel (9. táblázat). A korai MBIE gyors perivalvularis extenziót okozó agresszív, magas mortalitású betegség, mely sürgős reoperációt tesz szükségessé.
Empirikus kezelés
A hemokultúra eredményének megérkezése előtt megkezdett kezeléshez a várható kórokozónak megfelelő sémát válasszunk: NBIE-ben szubakut lefolyás esetén az 5. táblázat, urogenitalis vagy gastrointestinalis műtét után a 7. táblázat, szeptikus lefolyás esetén a 8. táblázat, korai MBIE-ben a 9/B, késői MBIE-ben a 9/A ajánlás szerint.
Gyógyszerszint-monitorozás
Az ajánlott adagolási sémák követése béta-laktám antibiotikumok esetén gyógyszerszint-monitorozás általában nem szükséges. Súlyos veseelégtelenségben a kreatininclearance-nek megfelelő dóziscsökkentés ajánlott. Az aminoglikozidok mélykoncentrációja <0,1 mg/l legyen a renalis és ototoxicus mellékhatások kivédésére. A vancomycin-mélykoncentrációnak a hatás biztosításához legalább 10-15 mg/l-nek kell lennie. Normális vesefunkció esetén a mérést elég egyszer elvégezni, de aminoglikozid-kombináció alkalmazásakor heti 2-3-szor ajánlatos (1).
Terhesség
Az IE nem jelent abszolút terhességmegszakítási indikációt. A felsorolt antibiotikumok teratogén hatása nem ismert, tehát adhatók.
Egyéb kezelés
Az ún. gócvizsgálatok és a gócok szanálása már a hatásos antibiotikus kúra első hetében elvégzendők, de mindenképpen a műtét előtt (lásd később).
Intracardialis vagy intravascularis idegen testek (PM-elektróda, kanülök) eltávolítása javasolt a diagnózis felállítása után.
Antikoaguláns kezelés bevezetése kontraindikált. Műbillentyűs betegeknél a kumarinkezelés folytatása feltétlenül szükséges, de instabil betegeknél a bármikor szükségessé válható műtét miatt a heparinra való áttérés ajánlott.
Szteroidkezelés az IE diagnózisa után rögtön elhagyandó.
Műtéti kezelés
Az IE aktív stádiumában, indikáció esetén a korai műtéti kezelés jelentheti a túlélés egyetlen esélyét (15). Aktív IE-ben az első műtét 1965-ben történt (44), hazánkban 1979-ben (14). Súlyos hemodinamikai szövődmények és antibiotikumokkal nem befolyásolható infekció esetén a műtét egyértelműen életmentő, bár a műtéti mortalitás még ma is 20% feletti. A műtéti mortalitás fő rizikótényezői a paravalvularis abscessus, a veseelégtelenség, az MBIE és a Staphylococcus-infekció (45). Az NBIE és a késői MBIE az esetek mintegy egyharmadában, a korai MBIE szinte minden esetben műtétet igényel. A jobb szívfél IE általában antibiotikus kezelésre gyógyul (46), műtét csak akkor indikált, ha az infekció 3 hét adekvát antibiotikus kezelés ellenére is fennáll.
MBIE-ben a szövődmények kialakulása után kezdett kezelés eredményei igen kedvezőtlenek műtéttel is, de főleg a nélkül. Ezzel szemben, ha TEE segítségével sikerül az MBIE diagnózisát felállítani a szövődmények (szívelégtelenség, paravalvularis leak, abscessus, embolisatio) kialakulása előtt, a műtéti mortalitás nem nagyobb, mint egyéb reoperációknál. Ilyenkor még a műtét is elkerülhető lehet a megfelelő antibiotikus kezeléssel (27).
A műtét általában műbillentyű-beültetést jelent, ami azonban újabb IE-re hajlamosít (10), ezért előtérbe került a billentyűt megtartó műtétek lehetősége vegetectomiával és billentyűplasztikával a mitralis és a tricuspidalis pozícióban (15, 48). A választandó műbillentyű - a tricuspidalis pozíció kivételével - a mechanikus műbillentyű, aorta subanularis vagy anularis szövődmények esetén esetleg homograft (15).
Ajánlás
A műtéti indikációkat a 12-15. táblázatban foglaltuk össze (C szintű ajánlások).
Perioperatív kezelés
Preoperatív szívkatéterezés
Koronarográfia a szokásos indikációkkal végzendő (40 éves életkor felett), egyéb szívkatéterezésre nincs szükség. Aortabillentyű IE-ben a koronarográfia embóliaveszéllyel járhat az aortás felszínen lévő nagy, mobilis vegetációk esetén, ezért ilyenkor a fokozott kockázat miatt koronarográfia előtt TEE-vizsgálat szükséges.
Cerebrális embólia után, ha a 48 órás CT alapján haemorrhagiás infarktus kizárható, a műtét optimális időpontja a stroke-ot követő 72 órán belül van (15).
Lépabscessus esetén a splenectomia a billentyűműtét előtt, urgens műtét esetén egy ülésben végzendő (15).
Preoperatív antibiotikus kezelés
A preoperatív antibiotikus kezelés időtartamára nincs ajánlás, műtéti indikáció esetén a műtét halasztása nem indokolt rövid ideig tartó antibiotikus kezelés miatt. Billentyűmegtartó műtét előtt viszont 1 hetes antibiotikus kezelés ajánlott (15).
Posztoperatív antibiotikus kezelés (1)
- Gyógyult, inaktív IE-ben antibiotikus kezelés nem szükséges.
- A preoperatív antibiotikus kúrát a kezelési táblázatban szereplő időtartamra kell kiegészíteni.
- Aktív IE-ben mindenképpen szükséges 1 hét posztoperatív kezelés a preoperatív folytatásaként.
- Pozitív billentyűtenyésztés esetén legalább 4 hét célzott posztoperatív kezelés kell, de MBIE, Staphylococcus és gomba esetén a kúra ajánlott időtartama legalább 6 hét.
Hol kezeljük az IE-ben szenvedő beteget?
Az infektív endocarditis számos diszciplínát érintő betegség, ezért olyan kórházban kell kezelni, ahol az alábbi feltételek hozzáférhetők. Mint fertőző betegség kívánatos, hogy biztosítva legyen a megfelelő mikrobiológiai diagnosztikus háttér. A beteg követésében nélkülözhetetlen az echokardiográfia, beleértve a transoesophagealis echokardiográfiát is, mely segít a műtéti indikáció felállításában, de a gyógyulás megítélésében is. Az akut lefolyású endocarditis és a műbillentyű-endocarditis csak szívsebészeti háttér biztosítása mellett kezelhető megnyugtatóan.
Prevenció
Az IE prevenciójának jelentőségét az húzza alá, hogy kezelés nélkül a betegség ma is fatális, de korszerű kezeléssel is magas a mortalitása. A prevenció azon az elven alapul, hogy fokozott kockázatú egyéneknél bacteriaemia kapcsán IE alakulhat ki. A bacteriaemia elsősorban eszközös beavatkozásokat követően lép fel, de lehet spontán is, pl. fogmosás kapcsán. Ugyanakkor a prevenció hatékonyságát nem bizonyítják randomizált vizsgálatok.
Ajánlás (C szint)
Az IE prevenciós ajánlásait a prevenciót igénylő betegcsoportok, beavatkozások és a javasolt antibiotikumok tekintetében az utolsó amerikai ajánlásra alapozzuk (49), amit a 16-22. táblázat tartalmaz.
Kockázatnak kitett betegcsoportok
A kardiális alapbetegség szerint a betegek magas, közepes és alacsony (elhanyagolható) kockázatú csoportokra (16. táblázat) oszthatók. IE-profilaxist csak a magas és közepes kockázatú betegek igényelnek (17. táblázat).
Bacteriaemiával járó beavatkozások
A leggyakoribb a fogászati, ezt követi az urogenitalis beavatkozás. A fogászatban általában a vérzéssel járó beavatkozásoknál kell profilaxist alkalmazni. A fogászati beavatkozások előtt antiszeptikus chlorhexidinnel történő szájöblítést javasolnak. A rezisztens kórokozók elkerülésére ajánlatos az egyes beavatkozások között 9-14 napos szünetet tartani. Urogenitalis beavatkozások előtt érdemes az esetleges húgyúti infekciót szanálni (3. generációs cephalosporin és aminoglikozid kombinációjával). A profilaxist igénylő, ill. nem igénylő beavatkozásokat a 18-20. táblázat foglalja össze.
Antibiotikumok
Az antibiotikus kezelés alapelvei:
- a kezelés közvetlenül a beavatkozás előtt történjen;
- a magas rizikójú betegek urogenitalis vagy gastrointestinalis beavatkozásait kivéve egyetlen adag kell;
- az antibiotikum bevitele lehetőleg orális legyen;
- az antibiotikum legyen biztonságos, jól felszívódó, és nyújtson megfelelő vérszintet.
Az antibiotikum megválasztásánál a beavatkozás kapcsán létrejövő bacteriaemia legvalószínűbb kórokozóját vesszük figyelembe: fogászati, légúti, oesophagus beavatkozásoknál a Streptococcus viridans, az urogenitalis és gastrointestinalis beavatkozásoknál az Enterococcus jön szóba. Szívműtétek és idegen anyagok beültetésénél (pacemaker, ICD) a profilaxis elsősorban Staphylococcus aureus ellen irányul.
Az alapvető antibiotikumok ma per os az amoxicillin, penicillinallergia esetén a clindamycin, parenteralisan az ampicillin, ill. vancomycin gentamicinnel vagy a nélkül.
A profilaktikus sémákat a 21., 22. táblázat mutatja be.
A szívműtét antibiotikus profilaxisa
Nyitott szívműtét
Műbillentyű-beültetés előtt és hajlamosító szívbetegség esetén a szívműtét előtt góckutatás, elsősorban fogászati vizsgálat és - lehetőség szerint - a talált gócok ellátása mindenképpen szükséges. A perioperatív antibiotikum megválasztásánál azt kell figyelembe venni, hogy a Staphylococcus aureus a legvalószínűbb kórokozó. A gyakorlatban az első generációs cephalosporinok váltak be, ez a jelenlegi ajánlás. Az antibiotikumot közvetlenül a műtét előtt kell kezdeni, és csak a posztoperatív 24. óráig kell adni a rezisztens kórokozók kialakulásának elkerülésére.
A posztoperatív bacteriaemia kivédésére fontos szempont, hogy az intenzív osztályon az intravascularis kanülök és a Swan-Ganz-katéterek a lehető legrövidebb ideig legyenek benn. Coronaria bypass műtét előtt rutinszerű profilaxis nem szükséges.
Pacemaker- és ICD-implantáció
Az alapelv ebben az esetben is a Staphylococcus aureus elleni védekezés. Egy nagy metaanalízis alapján a végleges pacemakerbeültetést követő „zsebinfekció” és a következményes jobb szívfél IE eredményesen megelőzhető a rutin perioperatív antibiotikus kezeléssel (50). Ennek ellenére rutinszerű perioperatív antibiotikus profilaxis nem ajánlott, de az IE-kockázatnak kitett betegcsoportokban a nyitott szívműtéthez hasonló antibiotikus kezelés javasolt (49).
Speciális körülmények
A reumás láz prevenciójaként adott folyamatos penicillinkezelés az IE megelőzésére elégtelen. Ezek a betegek más penicillinszármazékokra is rezisztensek lehetnek, ezért számukra IE-profilaxisként clindamycin, azithromycin vagy clarithromycin választandó (21. táblázat).
Fertőzött szövetekben történő beavatkozások során a legvalószínűbb kórokozó szerinti profilaxist választjuk: pl. methicillinrezisztens Staphylococcus aureust feltételezve vancomycint, urogenitalis infekcióban Gram-negatív bélbaktériumra gondolva 3. generációjú cephalosporint és aminoglikozidot adjunk.
Antikoaguláns kezelésen lévő betegek ne kapjanak intramuscularis injekciót.
1. táblázat Az IE Duke-kritériumai
1. Definitív IE
- Patológiai kritériumok:
- mikroorganizmusok: tenyésztéssel vagy hisztológiai módszerrel vegetációban, embóliában, intracardialis abscessusban
- patológiai elváltozások: vegetáció vagy intracardialis abscessus, aktív endocarditist igazoló hisztológiai lelettel
- Klinikai kritériumok:
- 2 major, vagy
- 1 major és 3 minor, vagy
- 5 minor kritérium
2. Lehetséges IE
- A leletek sem a definitív, sem a kizárt IE kritériumainak nem felelnek meg
3. Kizárt IE
- biztos alternatív diagnózis
- az endocarditis-tünetegyüttes 4 napon belül gyógyul
- műtét vagy szekció során IE nem igazolható 4 napos vagy annál rövidebb antibiotikus kezelés után
2. táblázat A Duke klinikai kritériumok definíciója. Major kritériumok
1. Pozitív hemokultúra
- típusos mikroorganizmus 2 mintából
- Streptococcus viridans, S. bovis, HACEK, vagy
- közösségben szerzett S. aureus, vagy Enterococcus, vagy
- perzisztáló pozitív hemokultúra
- 12 órás időközben levett 2 mintából, vagy
- mindhárom vagy 4, illetve több minta többsége pozitív úgy, hogy az első és utolsó között legalább 1 óra legyen
2. Endocardialis érintettség bizonyítása
- pozitív echokardiogram
- oszcilláló intracardialis terime billentyűn, subvalvularis struktúrán, vagy intracardialis idegen testen, vagy
- abscessus, vagy
- új műbillentyű paravalvularis dehiscentia, vagy
- új regurgitatiós zörej (régi zörej változása nem elég!)
3. táblázat A Duke klinikai kritériumok definíciója. Minor kritériumok
- Prediszponáló szívbetegség vagy iv. kábítószer-élvezet
- Láz: legalább 38 °C
- Vascularis tünetek: artériás embólia, szeptikus tüdőinfarktus, mikotikus aneurizma, intracranialis vérzés, Janeway-laesio
- Immunjelenségek: glomerulonephritis, Osler-csomók, Roth-foltok, reumatoid faktor
- Echokardiográfia: IE-re utaló jelek, de nem elégítik ki a major kritériumokat
- Mikrobiológiai lelet: pozitív hemokultúra, mely nem elégíti ki a major kritériumokat, vagy IE-nek megfelelő kórokozó szerológiai bizonyítéka
4. táblázat Mikroorganizmusok százalékos megoszlása IE-ben
| Mikroorganizmus | Natív billentyű IE | Műbillentyű IE |
|---|
| Korai típusú | Késői típusú |
|---|
| Streptococcusok | 50 | 10 | 30 |
| Viridans Streptococcusok | 35 | - | 25 |
| S. bovis | 15 | - | 5 |
| Enterococcus spp. | 10 | - | 5 |
| Staphylococcusok | 25 | 50 | 40 |
S. aureus
Koaguláz-negatív
Staphylococcusok | 23
2 | 15
35 | 10
30 |
| Difteroidok | - | 10 | 5 |
| Gram-negatívak | 6 | 15 | 10 |
| Gombák | 1 | 10 | 5 |
| Egyéb, HK-negatív | 8 | 5 | 5 |
5. táblázat NBIE kezelése Streptococcus viridans vagy bovis esetén MIC≤0,1 mg/l
| Antibiotikum | Napi adag | Időtartam (hét) | Megjegyzés |
|---|
| Penicillin G | 12-18 ME infúzió 4
6 adagban | 4 | >65 év vagy
beszűkült vesefunkció |
| Ceftriaxon | 2 g iv.
1 adagban | 4 | |
| Penicillin G + gentamicin | 12-18 ME infúzió 2
6 adagban,
3x1 mg/kg iv. | 2
2 | |
| Penicillinallergia: vancomycin | 30 mg/kg infúzió
2 adagban,
max. 2x1 g | 4 | |
6. táblázat NBIE kezelése mérsékelten penicillinrezisztens Streptococcusok esetén (penicillin MIC 0,1-0,5 mg/l)
| Napi adag | Időtartam (hét) | Megjegyzés |
|---|
Penicillin 18 ME iv. 6 adagban
+ gentamicin 3x1 mg/kg | 4
2 | |
| Vancomycin 30 mg/kg 2 adagban | 4 | Magas fokú penicillin-rezisztencia vagy -allergia esetén |
7. táblázat Enterococcus NBIE kezelése
| Antibiotikum | Adag/nap | Időtartam (hét)* |
|---|
Penicillin G
+ gentamicin | 18-30 ME infúzió 6 adagban
3x1 mg/kg iv. | 4-6
4-6 |
Ampicillin
+ gentamicin | 12 g iv 6 adagban
3x1 mg/kg iv. | 4-6
4-6 |
Penicillinallergia:
vancomycin
+ gentamicin | 30 mg/kg infúzió, max. 2x1 g
3x1 mg/kg iv. | 4-6
4-6 |
* 4 hetes kúra, ha a tünetek <3 hónapja kezdődtek, 6 hetes kúra, ha >3 hónapja
8. táblázat Staphylococcus NBIE kezelése
| Antibiotikum | Napi adag | Időtartam (hét)* |
|---|
Methicillinérzékeny Staphylococcusok:
oxacillin
+ gentamicin | 12 g iv. 6 adagban
3x1 mg/kg iv. | 4-6
3-5 nap |
Penicillinallergia:
vancomycin
gentamicin | 30 mg/kg infúzió 2 adagban
max. 2x1 g
3x1 mg/kg iv. | 4-6
3-5 nap
4-6 |
Methicillinrezisztens
Staphylococcusok:
vancomycin |
30 mg/kg infúzió 2 adagban
max. 2x1 g |
4-6 |
9. táblázat Staphylococcus MBIE vagy pacemaker/kanül IE kezelése
| Antibiotikum | Napi adag | Időtartam (hét) |
|---|
A) Methicillinérzékeny
Staphylococcus:
oxacillin
+ rifampicin
+ gentamicin |
12 g iv. 6 adagban ≥6*
3x300 mg p. os
3x1 mg/kg iv. |
≥6
≥6
2 |
B) Meticillinrezisztens
Staphylococcus:
vancomycin
+ rifampicin
+ gentamicin |
30 mg/kg infúzió 2 adagban
3x300 mg p. os
3x1 mg/kg |
≥6
≥6
2 |
* Penicillinallergia esetén vancomycin javasolt
10. táblázat HACEK okozta IE kezelése
| Antibiotikum | Napi adag | Időtartam (hét) |
|---|
| Ceftriaxon | 1x2 g iv. | 4 |
Ampicillin
+ gentamicin | 12 g iv. 6 adagban
3x1 mg/kg | 4
4 |
11. táblázat Gomba és negatív hemokultúrájú IE kezelése
| Antibiotikum | Napi adag | Időtartam (hét) |
|---|
Gomba IE:
Amphotericin B
+/- flucytosin |
1 mg/kg iv.
150 mg/kg p. os, 4 adagban |
6-8
6-8 |
Negatív hemokultúra:
vancomycin
+ gentamicin |
30 mg/kg infúzió, 2 adagban
3x1 mg/kg iv. |
6
6 |
12. táblázat Abszolút műtéti indikációk NBIE-ben
- Közepes vagy súlyos szívelégtelenség új keletű akut aorta- vagy mitralis insufficientia következtében
- Perzisztáló infekció (láz, bacteriaemia) 7-10 nap adekvát antibiotikus kezelés ellenére, billentyű-diszfunkcióval
- Paravalvularis abscessus, vagy pseudoaneurysma, vagy fisztula
- Gomba IE
13. táblázat Relatív műtéti indikációk NBIE-ben
- Recidív embólia adekvát antibiotikus kezelés mellett
- Nagyméretű (>10 mm) mobilis vegetáció antibiotikus kezelés előtt vagy annak első hetében
- Gram-negatív vagy más, nehezen befolyásolható baktériumok
14. táblázat Abszolút műtéti indikációk MBIE-ben
- Korai MBIE
- Műbillentyű-diszfunkció okozta szívelégtelenség (obstrukció vagy regurgitatio)
- Gomba IE
- Paravalvularis leak, abscessus, pseudoaneurysma, fisztula, új keletű vezetési zavar
- Antibiotikus kezelésre rezisztens Staphylococcus vagy más organizmus 7-10 nap után
- Gram-negatív kórokozó
15. táblázat Relatív műtéti indikációk MBIE-ben
- Perzisztáló bacteriaemia 7-10 napos adekvát kezelés után
- Recidív embólia adekvát antibiotikus kezelés mellett
16. táblázat IE-prevencióra nem szoruló betegek
- Izolált ASD
- Operált VSD vagy Botallo-vezeték műtét után 6 hónappal, ha nincs residuum
- CABG után
- Mitralis billentyűprolapsus, regurgitatio nélkül
- Ártatlan szívzörej
- Reumás láz utáni állapot, billentyűhiba nélkül
- Pacemaker vagy defibrillátor implantációja után
ASD = pitvari septumdefektus; VSD = kamrai septumdefektus; CABG = coronaria bypass műtét
17. táblázat IE-prevenciót igénylő betegek
Magas kockázatú betegek
- műbillentyűs betegek
- IE a kórelőzményben
- komplex cianotikus szívbetegség (univentricularis szív, nagyér-transzpozíció, Fallot-tetralógia)
- aorta pulmonalis sönt utáni állapot
Közepes kockázatú betegek
- egyéb congenitalis szívbetegség
- szerzett billentyűhibák
- HCM
- mitralis billentyűprolapsus regurgitatióval és/vagy megvastagodott billentyűvel
HCM = hipertrófiás cardiomyopathia
18. táblázat Fogászati beavatkozások IE-profilaxisa
Profilaxis szükséges
- foghúzás
- periodontalis beavatkozások, beleértve a depurálást
- gyökércsatorna-beavatkozások
- intraligamentaris helyi érzéstelenítés
Profilaxis nem szükséges
- fogpótlás
- fogtömés
- mintavétel
- fogászati röntgen
- varratszedés
19 táblázat. Egyéb beavatkozások IE-profilaxisa
Profilaxis szükséges
Légúti beavatkozások:
- tonsillectomia
- merev bronchoszkóp alkalmazása
Gastrointestinalis beavatkozások*:
- oesophagusvarixok szkleroterápiája
- endoszkópiás retrográd kolangiográfia epeút-obstrukció esetén
- epeútműtétek
- bélnyálkahártyát érintő műtétek
Urogenitalis beavatkozások:
- prosztataműtét
- cisztoszkópia
- urethradilatatio
* Magas rizikójú betegeknek ajánlott, közepes rizikójú betegeknél választható
20. táblázat Egyéb beavatkozások IE-profilaxisa
Profilaxis nem szükséges
Légúti beavatkozások:
- intubálás
- flexibilis bronchoszkóp
Gastrointestinalis beavatkozások:
- transoesophagealis echokardiográfia
- endoszkópia, biopsziával vagy a nélkül
Urogenitalis beavatkozások:
- vaginalis hysterectomia
- vaginalis szülés
- császármetszés
Egyéb:
- szívkatéterezés, PTCA
- pacemaker, defibrillátor implantációja
21. táblázat Fogászati, légúti és oesophagealis beavatkozások profilaktikus antibiotikus sémái
| Sématípus | Gyógyszer | Dózis |
|---|
| Alap | Amoxicillin | Felnőtt: 2 g per os, gyermek: 50 mg/kg, 1 órával a beavatkozás előtt |
| Orális bevitel nem lehetséges | Ampicillin | Felnőtt: 2 g iv., gyermek: 50 mg/kg iv., 30 perccel a beavatkozás előtt |
| Penicillinallergia | Clindamycin* | Felnőtt: 600 mg per os, gyermek: 20 mg/kg per os, 1 órával a beavatkozás előtt |
| Penicillinallergia, és orális bevitel nem lehetséges | Clindamycin | Felnőtt: 600 mg iv., gyermek: 20 mg/kg iv., 30 perccel a beavatkozás előtt |
* Clindamycin helyett azithromycin vagy clarithromycin is adható 500 mg felnőtt-, illetve 15 mg/kg gyermekadagban per os, de ezek jóval drágább készítmények
22. táblázat Urogenitalis és gastrointestinalis beavatkozások profilaktikus antibiotikus sémái
| Sématípus | Gyógyszer | Dózis |
|---|
| Magas rizikójú beteg | Ampicillin + gentamicin | Felnőtt: 2 g iv., gyermek: 50 mg/kg iv., 1,5 mg/kg iv., beavatkozás előtt 30 perccel |
Ampicillin
vagy
amoxicillin | Felnőtt: 1 g iv., gyermek: 25 mg/kg iv., 6 óra múlva |
| Felnőtt: 1 g per os, gyermek: 25 mg/kg per os, 6 óra múlva |
| Magas rizikójú penicillinallergiás beteg | Vancomycin + gentamicin | Felnőtt: 1 g iv., gyermek: 20 mg/kg iv., 1,5 mg/kg iv., beavatkozás előtt 30 perccel befejezve |
| Közepes rizikójú betegek | Amoxicillin vagy ampicillin | Felnőtt: 2 g per os, gyermek: 50 mg/kg per os, felnőtt 2 g iv., gyermek 50 mg/kg iv, a beavatkozás előtt 1, illetve 1/2 órával |
| Közepes rizikójú penicillinallergiás betegek | Vancomycin | Felnőtt 1 g iv., gyermek 20 mg/kg iv., beavatkozás előtt 30 perccel befejezve |
Irodalom
- Horstkotte, D., Follath, F., Graevenitz, A., Gutschik, E., Hess, J., Lengyel, M., Oto, M. A., Pavie, A., Soler-soler, J., Thiene, G.: Recommendations for prevention, diagnosis and treatment of infective endocarditis. The Task Force on IE of ESC. Eur. Heart J. 2001. In press.
- Lengyel, M.: Infektív endokarditis. Kardiologia, 2000. Szerk.: Temesvári A., Gyenes G. Melánia. Budapest, 2000, 441-455.
- Durack, D. T., Lukes, A. S., Bright, D. K. et al.: New criteria for the diagnosis of infective endocarditis: utilization of specific echocardiographic findings. Am. J. Med. 1994;96:200-9.
- Bonow, R. D., Carabello, B., DeLeon, A. C. ACC/AHA Guidelines for the management of patients with valvular heart disease. J. Am. Coll. Cardiol. 1998;32:1486-588.
- Wilson, W. R. and the Endocarditis Working Group of the International Society for chemotherapy. Antibiotic treatment of infective endocarditis due to viridans streptococci, enterococci and other streptococci and other streptococci. Clin. Microbiol. Infect. 1998;4:3 S17-26.
- Working Party Report of the British Society for Antimicrobiol Chemotherapy. Antibiotic treatment of streptococcal, enterococcal and staphylococcal endocarditis. Heart. 1998;79:207-10.
- Durack, D. T. and Endocarditis Working Group of the International Society for Chemotherapy: Approach to diagnosis of infective endocarditis. Clin. Microbiol. Infect. 1998;4:S3-9.
- Gutschik, E. and the Endocarditis Working Group on the International Society for Chemotherapy. Clin. Microbiol. Infection. 1998;4:S10-16.
- Calderwood, S. B., Swinski, L. A., Waternaux, C. M. et al.: Risk factors for the development of prosthetic valve endocarditis. Circulation. 1985;72:31-7.
- Árvay, A., Lengyel, M.: Incidence and risk factors of prosthetic valve endocarditis. Eur. J. Cardiothorac. Surg. 1988;2:340-6.
- Bayer, A. S.: Infective enodcarditis - state of the art. Clin. Inf. Dis. 1993;17:313-322.
- Lamas, C. C., Eykyn, S. J.: Hospital aquired native valve endocarditis: analysis of 22 cases presenting over 11 years. Heart. 1998;79:442-7.
- Caconb, P., Leprince, P., Nataf, P. et al.: Pacemaker infective endocarditis. Am. J. Cardiol. 1998;82:480-4.
- Árvay, A., Lengyel, M.: Early operation for infective endocarditis and the activity of infection. Z. Kardiol. 1986;85(Suppl.2):186-190.
- Petterson, G., Carbon, C. and the Endocardtiis Working Group of the International Society of Chemotherapy. Recommendations for surgical treatment of endocarditis. Clin. Microbiol. Infect. 1998;4(Suppl.3):34-46.
- Netzer, R. O. M., Zollinger, E., Seiler, C., Cerny, A.: Infective endocarditis: clinical spectrum and outcome. An analysis of 212 cases. 1980-95. Heart. 2000;84:25-30.
- Lamas, C. C., Eykyn, S. J.: Suggested modifications to the Duke criteria for the clinical diagnosis of native valve and prosthetic valve endocarditis: analysis of 118 pathologically proven cases. Clin. Infect. Dis. 1997;25:713-9.
- Bayer, A. S., Bolger, A. F., Taubert, K. A. et al.: Diagnosis and management of infective endocarditis and its complications. AHA Scientific Statement. Circulation. 1998;98:2936.
- Stamboulian, D., Carbone, E.: Recognition, management and prophylaxis of endocarditis. Drugs. 1997;54:730-44.
- Ali, A. S., Lesch, M.: Culture-negative endocarditis - a historical review and 1990s update. Progr. Cardiovasc. Dis. 1994;37:149.
- Tingleff, J., Egeblod, H., Gotzsche, G-O. et al.: Perivalvular cavities in endocarditis: abscesses versus pseudoaneurysms? A transesophageal Doppler echocardiographic study in 118 patients with endocarditis. Am. Heart J. 1995;130:93.
- Afridi, I., Apostolidou, M. A., Saad, R. M., Zoghbi, W. A.: Pseudoaneurysms of the mitral-aortic intervalvular fibrosa: dynamic characterization using transesophageal echocardiographic and Doppler techniques. J. Am. Coll. Cardiol. 1995;25:137.
- DeCastro, S., d'Amatig., Cartoni, D. et al.: Valvular perforation in left-sided infective endocarditis: a prospective echocardiographic evaluation and clinical outcome. Am. Heart J. 1997;134:656.
- Birmingham, G. P., Rahko, P. S., Ballantyne, F.: Improved detection of infective endocarditis with transesophageal echocardiography. Am. Heart J. 1992;123:774.
- Lowry, R. W., Zoghbi, W. A., Baker, W. B. et al.: Clinical impact of transesophageal echocardiography in the diagnosis and management of infetive endocarditis. Am. J. Cardiol. 1994;73:1089.
- Werner, G. S., Schulz, R., Fuchs, J. B. et al.: Infective endocarditis in the elderly in the era of transesophageal echocardiography: clinical features and prognosis compared with younger patients. Am. J. Med. 1996;100:90-97.
- Lengyel, M.: The impact of transesophageal echocardigoraphy on the management of prosthetic valve endocarditis: experience of 31 cases and review of the literature. J. Heart Valve Dis. 1997;6:204.
- Daniel, W. G., Mügge, A., Martin, R. P. et al.: Improvement in the diagnosis of abscessus associated with endocarditis by transesophageal echocardiography. N. Engl. J. Med. 10991;324:95.
- Karalis, D. G., Bansal, R. C., Hanck, A. J. et al.: Transesophageal echocardiographic recognition of subaortic complications in aortic valve endocarditis. Circulation. 1992;86:353.
- San Roman, J. A., Vilacosta, I., Zamorano, J. L. et al.: Transesophageal echocardiography in right-sided endocarditis. J. Am. Coll. Cardiol. 1993;21:1226.
- Fowler, V. G., Sanders, L. L., Kong, L. K. et al.: Infective endocarditis due to Staphylococcus aureus: 59 prospectively identified cases with follow-up. Clin. Infect. Dis. 1999;28:100.
- Rosen, A. B., Fowler, V. G., Corey, R. et al.: Cost-effectiveness of transesophageal echocardiography to determine the duration of therapy for intravascular catheter-associated Staphylococcus aureus bacteremia. Ann. Intern. Med. 1999;130:810.
- Tischler, M. D., Vaitkus, P. T.: The ability of vegetation size on echocardiography to predict cklkinical complications: a metaanalysis. J. Am. Soc. Echocardiogr. 1997;10:562.
- Mügge, A., Daniel, W. G., Lichtlen, F. G.: Echocardiography in infective endocarditis: reassessment of prognostic implications of vegetation size determined by the transthoracic and transesophageal approach. J. Am. Coll. Cardiol. 1989;14:631.
- DeCastro, S., Magni, G., Beni, S. et al.: Role of transthoracic and transesophageal echocardiography in predicting embolic events in patients with active infective endocarditis involving native cardiac valves. Am. J. Cardiol. 1997;80:1030.
- Heinle, S., Wilderman, N., Arrison, J. K. et al.: Value of transthoracic echocardiography in predicting embolic events in active infective endocarditis. Am. J. Cardiol. 1994;74:799.
- Rohmann, S., Erbel, R., Darius, H. et al.: Prediction of rapid versus prolonged healing of infective endocarditis by monitoring vegetation size. J. Am. Soc. Echocardiogr. 1991;4:465.
- Steckelberg, J., Murphy, J., Ballard, D. et al.: Emboli in infective endocarditis: the prognostic value of echocardiography. Ann. Intern. Med. 1991;114:635.
- Wladika, Zs., Lengyel, M., Zorándi, Á.: Embolic risk of vegetations in infective endocarditis: a clinical follow-up. Eur. J. Echocardiogr. 2000;1(S):108.
- Sochowski, R. A., Chan, K. L.: Implication of negative results on a monoplane transesophageal echocardiographic study in patients with suspected infective endocarditis. J. Am. Coll. Cardiol. 1993;21:216.
- Roe, M. T., Abramson, M. A., Li, J. et al.: Clinical information determines the impact of transesophageal echocardiography on the diagnosis of infective endocarditis by the Duke criteria. Am. Heart J. 2000;139:945.
- Heidenreich, P. A., Masoudi, F. A., Maini, B. et al.: Echocardiography in patients with suspected endocardtiis: a cost-effectiveness analysis. Am. J. Med. 1999;107:198.
- Thalme, A., Nygren, A. T., Julander, I., Freyschuss, U.: Endocarditis: clinical outcome and benefit of transesophageal echocardiography. Scand J. Infect. Dis. 2000;32:303.
- Wallace, A. G., Young, W. G., Osterhout, S.: Treatment of acute bacterial endocarditis by valve excision and replacement. Circulation, 1965;31:450-3.
- Mullany, C. J., Chua, Y. L., Schaff, H. V. et al.: Early and late survival after surgical treatment of culture positive active endocarditis. Mayo Clin. Proc. 1995;70:517-25.
- Robbins, M. J., Soliro, R., Frishman, W. H.: Right-sided valvular endocarditis: etiology, diagnosis and an approach to therapy. Am. Heart J. 1986;11:128-135.
- Moon, M. R., Stinson, E. B., Miller, D. C.: Surgical treatment of endocarditis. Progr. Cardiovasc. Dis. 1997;40:239-264.
- Lukács, L., Haán, A., Bartek, I. és mtsai: Infectiós endocarditis sebészi kezelése a billentyű megtartásával. Cardiol. Hung. 1993;22:23-26.
- Dajani, A. S., Taubert, K. A., Wilson, W. et al.: Prevention of bacterial endocarditis. Recommendations by the AHA. Circulation. 1997;96:359-66.
- DaCosta, A., Kirkorian, G., Cucherat, M. et al.: Antibiotic prophylaxis for permanent pacemaker implantation. A meta-analysis. Circulation. 1998;97:1796-1801.





