Thromboemboliák megelőzése és kezelése
(műbillentyűvel élők antitrombotikus gondozása)
• Kardiológiai Szakmai Kollégium •
Írták: Kiss Róbert Gábor, Lengyel Mária (munkacsoport-vezető)
Bevezetés
A thromboemboliás szövődmények (események) jelentős szerepet játszanak a szívbetegségek morbiditásában és mortalitásában. A legfontosabb terápiás eszköz a prevenció. A gyógyszeres prevenciót az antitrombotikus terápia jelenti.
A szakmai ajánlás összeállítása elsősorban a rendelkezésre álló nemzetközi (1-4) és hazai ajánlások (5) áttekintésén alapul. A közöttük lévő ellentmondások miatt egyéb irodalomkutatásra is szükség volt a Medline segítségével.
A szakmai ajánlások lehetőség szerint evidenciákon, ezek hiányában konszenzuson alapulnak. A thromboemboliás betegségek kezelésében A szintű evidenciák csak a nonvalvularis pitvarfibrilláció antitrombotikus prevenciójára vonatkozólag állnak rendelkezésre, melyek többes randomizált vizsgálatokból származnak. A többi ajánlás C szintű evidenciákon alapul.
Jelen ajánlás tárgya csak a bal szívfélben kialakuló thrombusok és azok embóliás szövődményeinek prevenciója és kezelése, mivel a jobbszívfél-thrombusok a vénás thromboemboliás betegségek körébe tartoznak, és így külön ajánlás foglalkozik velük.
Az antitrombotikus terápia formái
A gyógyszeres kezelés preventív vagy terápiás célú lehet.
Primer prevenció
Hajlamosító szívbetegség és/vagy thromboemboliás rizikófaktorok esetén az első thromboemboliás (TE) esemény kivédésére irányuló kezelés.
Szekunder prevenció
A TE után újabb esemény (stroke, perifériás embólia) kivédése.
Terápiás alkalmazás
A kezelés célja a thromboemboliát okozó intracardialis thrombusok oldása. Az embóliák (stroke, perifériás embólia) kezelése nem tartozik az ajánlás tárgyához, más szakmák kompetenciájába tartozik (neurológia, angiológia).
Antitrombotikus gyógyszerek
Az intracardialis thrombusok túlnyomó részben fibrint tartalmaznak, a műbillentyűkön kialakuló thrombusokban thrombocyták is szerepet játszanak. Ezért a kardiogén thromboemboliák primer és szekunder prevenciójában az orális antikoaguláns kezelésnek van döntő szerepe. A gyors antikoaguláns kezelést vagy az orális antikoaguláns kezelés helyettesítését heparinkészítményekkel lehet megvalósítani. A thrombocytaaggregáció-gátlóknak alárendelt jelentősége van. A műbillentyű-trombózis prevenciójában az antikoaguláns és a thrombocytaaggregáció-gátló kezelés kombinációja is felmerül. A thrombolyticus kezelés a jelen ajánlás vonatkozásában csak a műbillentyű-trombózis terápiájában jön szóba.
Orális antikoaguláns kezelés
Az orális antikoagulánsok kumarinkészítmények, melyek K-vitamin-antagonistaként fejtik ki hatásukat. Az antikoaguláns proteinek (protein C és S) hatásának gyors csökkentése révén paradox hatásuk is lehet. Ezért a terápia kezdetén nagy, telítő dózisokat nem alkalmazunk. A nagy randomizált tanulmányok a coumadin (warfarin) alkalmazásán alapulnak, a hazai acenokumarol- (Syncumar) készítmény hatékonysága a warfarinénak mintegy 2,5-szerese, a dózisarányban kifejezve. Ugyanakkor a warfarin hosszabb hatásfelezési ideje (36 óra) ellenére nem biztosít stabilabb hatást a Syncumarnál (10 óra) (5a).
A kumarinhatás ellenőrzésére az INR (international normalised ratio) szolgál, amit a protrombinráta helyett már 1986-ban bevezettek. Ez a módszer teszi lehetővé az egyes laboratóriumokban alkalmazott tromboplasztin fajtájától független egységes mérést. Az INR a beteg és a normál plazma protrombinidejének hányadosa ISI-kitevővel (International Sensitivity Index), mely az aktuálisan használt tromboplasztin érzékenységét jelzi. A korábban használt protrombinszázalék túlhaladott, kerülendő és a kiadott leletben sem szabad feltüntetni. Újabban az ún. „point of care” módszerrel ujjbegyből vett vérmintán a rendelőben vagy akár a beteg által otthon is van pontos INR-meghatározásra lehetoség. Ez lerövidíti a kumarinbeállítás folyamatát (beteg-orvos-labor-orvos-beteg helyett beteg-orvos vagy beteg önmagában), költséghatékony és biztonságos, a coaguchek monitorral van a legtöbb pozitív nemzetközi tapasztalat (5b).
A cél INR a mechanikus műbillentyűk kivételével 2,0-3,0 között van, tehát 2,0 alatti INR esetén antitrombotikus hatás nem várható. A kumarinkezelés beállítását az átlagos fenntartó adaggal kell kezdeni, ez 2-4 mg Syncumarnak felel meg. Az antitrombotikus hatás kialakulására 2-5 napig nem számíthatunk, ezért manifeszt trombózis vagy magas trombózisrizikó esetén a kumarint mindig teljes adagú hagyományos heparin- vagy kis molekulatömegű heparin- (LMWH) védelemben szabad csak elkezdeni. Az ún. átfedés után a heparint akkor hagyjuk el, ha a cél INR legalább 2 napon át fennáll. A beállítás kezdetén az INR ellenőrzése 1-2 hétig hetente 2-3-szor szükséges, majd a stabil értékek elérése esetén ritkábban, de legalább havonta 1 alkalommal. A cél a terápiás tartomány maximális időtartamának elérése (6). Ezt befolyásolja a számos gyógyszer-interakció, a táplálék változó K-vitamin-tartalma, a K-vitamin-felszívódást befolyásoló betegségek és a beteg nem megfelelő együttműködése.
Magas INR (vérzéssel vagy a nélkül) kezelése alapjában 3 megközelítéssel befolyásolható:
- a kumarin átmeneti elhagyása vagy csökkentése;
- K-vitamin adása;
- friss fagyasztott plazma (FFP) adása.
Ajánlás magas INR-szint esetén (6) (C szint)
- Ha az INR terápiás szint feletti, de <5,0, vérzés nincs: elég az adag átmeneti csökkentése.
- Ha az INR 5,0-9,0 között van, vérzés nélkül, akkor egy adag kihagyása, vérzés vagy vérzésveszély esetén 1-2,5 mg orális K-vitamin adása és gyakori INR-kontroll javasolt. Sürgős műtét előtt 2-4 mg orális K-vitamin javasolt, és ez 24 óra múlva 1-2 mg adásával kiegészíthető.
- Ha az INR >9,0, vérzés nélkül, akkor a Syncumar kihagyása és 3-5 mg orális K-vitamin adása javasolt, ez 24-48 óra múlva szükség esetén megismételhető.
- Ha az INR >9,0, súlyos vérzéssel, akkor a Syncumar kihagyása mellett 10 mg K-vitamin-infúzió adandó, ezt 12 óránként lehet ismételni, és a klinikumtól függően FFP adása is szükséges.
- Életveszélyes vérzés esetén első helyen protrombin komplex koncentrátum adandó, 10 mg K-vitamin, szükség esetén 12 óránként ismételt infúziós adásával kiegészítve.
- Ha a kumarinkezelés további folytatására van szükség, a K-vitamin hatásának elmúlásáig (5-7 napig) terápiás adagú heparinkezelés javasolt, ezután lehet csak a kumarinkezelést megkezdeni további heparinvédelemben.
Invazív beavatkozások
Foghúzás a terápiás INR-tartomány alsó régiójában elvégezhető, artériás punkció 2,0-2,5 INR mellett, műtét 1,6 INR alatt végezhető.
Kumarin- (Syncumar-) allergia
Súlyos allergia esetén egy másik csoportba tartozó K-vitamin-antagonista adandó, pl. Syncumar helyett indandion (Dindevan), coumadin (warfarin, Waran), melynek során ugyanúgy INR-kontrollt alkalmazunk.
Orális direkt trombin inhibitor adásával a SPORTIF III-V tanulmányban a kumarinnal azonos stroke-prevenciós hatást lehetett elérni krónikus pitvarfibrillációban anélkül, hogy a vérzésveszély fokozódott volna. A Ximelagatran előnye, hogy fix dózisban adható, monitorozás nem szükséges, és nincs étel-gyógyszer interakció (6a).
Heparin (nem frakcionált, hagyományos heparin)
Molekulatömege 17 000 körüli. Fő hatása a trombin semlegesítése, antitrombin-III aktiválás révén. Beadása után az endotheliumhoz, plazmafehérjékhez kötődik, a beadott mennyiség biológiai hasznosulása nem éri el a 30%-ot, nagy egyéni különbségeket mutathat. Egy adott személynél is az idő múlásával, illetve az adott betegség zajlásával párhuzamosan megváltozhat a terápiás hatás eléréséhez szükséges dózis. Ezért szükséges a heparinkezelés szoros laboratóriumi monitorozása. Adagolása során 5000 E iv. bolusz után 1000-1200 E/óra adagolásra térünk át, és a hatást aktivált parciális tromboplasztinméréssel ellenőrizzük, a kívánatos APTI-megnyúlás a normál kontrollnak az 1,5-2-szerese. A heparininfúzió adagjának illesztésére léteznek nomogramok.
A heparin intravénás protamin-szulfáttal prompt antagonizálható.
A heparinkezelés mellékhatásai: alopecia, májenzim-emelkedés (jelentős is lehet!), urticaria, tartós adás esetén osteoporosis, a beadás helyén jelentkező haematoma, bőrnekrózis.
Heparin indukálta thrombocytopenia: dózisfüggetlen, heparin ellen termelt immunglobulinok által létrehozott kórkép. Klinikai tünete nem a vérzés, hanem a trombózis. Tipikusan a 4-10. nap között lép fel, ismételt heparinadáskor hamarabb. Ezért heparinadás közben a thrombocytaszám rendszeres ellenőrzése szükséges, 30%-os csökkenés, illetve 100 000/ml alatti érték esetén a heparin haladéktalanul abbahagyandó, nyomnyi mennyiség is kerülendő. Trombotikus szövődmény, illetve elkerülhetetlenül szükséges további alvadásgátló kezelés APTI-val vezetett hirudinnal (lepirudin), illetve testsúlykilogrammra számolt danaparoiddal (Orgaran) javasolt. Sem a kis molekulatömegű heparinra való áttérés, sem pedig a minél előbbi kumarinkezelés megkezdése nem javasolt, utóbbi phlegmasia coerulea dolens kialakulásával fenyeget.
Kis molekulatömegű heparinok (LMWH-k)
Az LMWH-k hatásának laboratóriumi ellenőrzésére a rutin laboratórium nincs felkészülve, az APTI-t nem nyújtják meg, a hatás mérése antiXa assay segítségével lenne lehetséges, erre azonban a klinikai gyakorlatban, pontosan a jó biológiai hasznosulás miatt, nincs szükség.
Indikációs körét tekintve lényegében minden hagyományos heparinindikáció tekintetében megtörténtek az ekvivalenciavizsgálatok. Megállapítható volt, hogy mélyvénás trombózis esetén az LMWH a választandó kezelés, az LMWH teljes körben alkalmas a tromboprofilaxisra, legalább egyenértékű a hagyományos heparinnal. Instabil anginában hatékonysága azonos (nadroparin, dalteparin) vagy jobb (enoxaparin) az intravénás, illesztett dózisú hagyományos heparinkezelésnél. Szívüregi thrombus kezelésére, megelőzésére is alkalmas (7). Újabban mechanikus műbillentyűs betegeknél is van kedvező tapasztalat az LMWH-alkalmazásról, bár randomizált vizsgálatok még nem történtek (8). Az LMWH-adás biztonságossága érdekében antiXa-meghatározás is szükséges. Az FDA és az Aventis azonban nem javasolja az enoxaparint műbillentyűs betegekben (5b).
Thrombocytaaggregáció-gátlók
Acetilszalicilsav (aszpirin)
A thrombocyták ciklooxigenáz enzimét irreverzíbilisen megbénítja. Kellő orális dózisban (és nem bélben oldódó vagy mikrokapszulás formában) adva a hatás 20-40 percen belül jelentkezik, 5-6 nap alatt csökken, illetve szűnik meg az új, már nem bénított vérlemezkék megjelenésével. A vérzési időt megnyújtja.
Akut coronariaszindrómákban, instabil anginában, myocardialis infarktusban az akut kardiális történéseket, reinfarktust, halálozást egyértelműen csökkenti. Thrombocytabénító hatása irreverzíbilis, a gyógyszer olcsó. Vénás, valamint szívüregekben létrejövő trombózis megelőzésére nem alkalmas. A minimális effektív dózis két napon át végzett 250 mg telítés után 100 mg naponta. A minimális effektív dózis használata különösen olyan helyzetekben javasolt, ahol antikoagulánssal együtt alkalmazzák, így a vérzésveszély csökkenthető.
Ticlopidin
Thienopyridinszármazék, mely a thrombocyta ADP-receptorát (PY12) irreverzíbilisen bénítja. A hatás kialakulásához 2-3 nap szükséges. A hatás a thrombocytán irreverzíbilis, a gyógyszer elhagyását követően 4-10 napon át megfigyelhető. Akut betegség kezelésére a fentiek miatt kevéssé alkalmas. Adagja 500 mg naponta. Randomizált vizsgálatok szerint instabil anginában, CABG-műtét után, cerebrovascularis betegségekben hatása eléri, illetve némileg meghaladja az aszpirinét.
Indikációk: aszpirinintolerancia, a kérdéses aszpirin-nonreszponzió, illetve -allergia esetén alkalmazása mindenképpen indokolt.
Mellékhatásai: hasmenés, bőrkiütés, neutropenia.
Clopidogrel
Újabb thienopyridinszármazék, a ticlopidin követő molekulája. Támadáspontja azonos elődjéével. Hatása azonban gyorsabban fejlődik ki, 48 óra elteltével várható. A molekula hatékonyabb, így dózisa egy nagyságrenddel alacsonyabb, napi 75 mg. 300 mg kezdő dózis esetén a hatás órákon belül létrejön. Ennek révén elérhető, hogy a ticlopidin rettegett mellékhatása, a neutropenia kiküszöbölhető legyen.
A thromboemboliás betegségek diagnózisa
Az intracardialis thromboembolia-források kimutatásának szuverén módszere az echokardiográfia. Ezt a módszert külön szakmai ajánlás tárgyalja. Röviden a bal kamrai thrombusok kimutatására a transthoracalis echokardiográfia (TTE), a bal pitvari (fülcse-) thrombus és a műbillentyű-trombózis diagnózisára csak a multiplan (esetleg biplan) transoesophagealis echokardiográfia (TEE) alkalmas. Az egyéb embóliaforrások kimutatására is a TEE szolgál. A bal pitvari spontán echókontraszt pretrombotikus állapotnak tekintendő, a nyitott foramen ovale csak vénás trombózissal együtt jelez paradox embóliaforrást, az aorta atherothrombosisa lehet forrás vagy marker, és az intracardialis embóliaforrásokkal együtt tárgyalják (4). A lehetséges embóliaforrások közé tartozó mitralis billentyűprolapsus, mitralis anulus kalcifikáció TTE-vel, a pitvari septumaneurysma TTE-vel vagy TEE-vel mutatható ki. A D-dimer-negativitás trombózis jelenlétét kizárja.
Ajánlás embóliaforrás keresésére (C szint)
Echokardiográfiás vizsgálat indikált perifériás embólia és ismeretlen eredetű, nem lacunaris stroke esetén.
- TTE indikált első lépésként.
- TEE indikált, ha a TTE negatív, de az intracardialis forrás klinikai gyanúja alapos, és antikoaguláns kezelés szóba jön.
- TEE indikált 45 évnél fiatalabb betegeknél, ha paradox embólia lehetősége felmerül.
- TEE indikációja kérdéses az aorta-atherothrombosis kimutatására, mivel ebben az esetben nincs egyértelmű antikoaguláns indikáció.
Echokardiográfiás vizsgálat indikált intracardialis thrombusra hajlamosító betegség vagy ilyen thrombus gyanúja esetén embolisatio nélkül is:
- TTE indikált akut myocardialis infarktusban (ST-elevációs, Q-infarktus) bal kamrai thrombus kimutatására;
- TEE indikált bal pitvari thrombus kimutatására pitvarfibrillációban, ha az antikoaguláns kezelés nagy rizikójú, vagy cardioversio előtt inadekvát, vagy hiányzó antikoaguláns előkészítés esetén;
- TEE indikált obstruktív és nonobstruktív műbillentyű-trombózis gyanúja esetén.
Thromboemboliás betegségek antitrombotikus profilaxisa
Nonvalvularis pitvarfibrilláció
A nonvalvularis pitvarfibrilláció (NVPF) a cardioemboliás ischaemiás stroke leggyakoribb oka. Az NVPF legsúlyosabb szövődménye, a stroke évi incidenciája 5-7%. Az NVPF a 65 év feletti korosztály 4%-ánál fordul elő, és a prevalencia az életkor előrehaladásával akár 10%-ra emelkedhet. A cél az optimális antitrombotikus prevenció.
A gyógyszeres kezelés előtt hangsúlyozni kell a sinusritmus helyreállításának és megtartásának (a pitvarfibrilláció gyógyszeres prevenciójának) jelentőségét (3).
Stroke-rizikó
Fiatal, szívbetegségben nem szenvedő egyének (lone pitvarfibrilláció) stroke-rizikója elhanyagolható.
A stroke-rizikót emelő faktorok: az életkor (10 évenként 1,4-szeres), az előző stroke vagy TIA (2,5-szeres rizikó), a diabétesz (1,7-szeres rizikó), a kezelt hipertónia (1,6-szeres rizikó), a szívelégtelenség, a balkamra- és a balpitvar-diszfunkció TEE-vel mért alacsony sebességű fülcseáramlás alapján (9-11). A stroke-rizikófaktorok 2 csoportba sorolhatók: magas és mérsékelt rizikót jelentő faktorok csoportjára (1. táblázat). A 2. táblázat foglalja össze a stroke előfordulását az életkor és a rizikófaktorok függvényében.
Antitrombotikus stroke-prevenció
Az 5 primer prevenciós randomizált tanulmányban (12-16) kimutatták, hogy kumarinkezeléssel a stroke-rizikó jelentősen csökken, ha az INR>2,0, míg a terápiás érték alatt védőhatás gyakorlatilag nem volt. Kumarinnal a stroke kockázatcsökkenése 68%-os, aszpirinnel csak 30%-os volt, sőt a halálozást csak a kumarin csökkentette (33%-kal). A szekunder prevencióban a stroke-rizikó csökkenése kumarinnal 66%-os volt, aszpirinnel pedig nem következett be kockázatcsökkenés (17).
A Cochrane-metaanalízis 16 tanulmány 9874 betegét dolgozta fel. Ebben a kumarinkezeléssel elért abszolút stroke-redukció a primer prevencióban évi 2,7%, a szekunder prevencióban 8,4% volt, míg aszpirinnel ugyanez mindössze 1,5, ill. 2,5%-ot tett ki (18).
Ugyanakkor a terápiás felső határérték (INR=3,0) felett a védőhatás nem fokozódott. Számottevő vérzésrizikóra csak efölött lehet számítani (19).
Alcsoportok
Intermittáló pitvarfibrilláció a tanulmányokban csak kisszámú betegnél fordult elő, de a stroke-rizikó a rizikófaktoroktól és az életkortól függően azonos volt a permanens pitvarfibrillációéval (10).
A pitvarlebegés a pitvarfibrillációval azonos elbírálás alá esik (10).
A rövid ideje (<48 óra) fennálló pitvarfibrilláció stroke-rizikója elhanyagolható (10).
Elektromos cardioversio és antikoaguláns kezelés
A 48 óránál hosszabb ideje fennálló NVPF elektromos cardioversiója (CV) után antikoaguláns kezelés nélkül az embóliaveszély 5,3%, antikoaguláns kezeléssel 0,8%. Az embóliaveszély 3-4 hétig tart. A bal pitvari thrombus szervülése antikoaguláns kezelés mellett 2-3 hetet vesz igénybe, ezért a CV előtt és után 3-4 hét antikoaguláns kezelést tartanak szükségesnek (10).
TEE-irányítású cardioversio
A TEE alkalmas a bal pitvari (fülcse)thrombus megbízható kimutatására. Ezért a CV akkor is elvégezhető, ha az NVPF fennállása >48 óra, de a bal pitvari thrombus TEE-vel kizárható. Ilyenkor is kötelező az adekvát antikoaguláns status biztosítása a CV alatt és utána 4 hétig. A TEE-vel látott spontán echókontraszt nem kontraindikálja a CV-t, de fülcsethrombus esetén 4-6 hét antikoaguláns kezelés után a TEE-t meg kell ismételni, és CV továbbra is csak akkor végezhető, ha fülcsethrombus nincs (20).
Gyógyszeres cardioversio
Új keletű NVPF esetén is indokolt a hospitalizált betegeknek intravénás heparint vagy „full” dózis LMWH-t adni a nagyobb biztonság érdekében, mivel a gyógyszeres kezelés hatékonyságának ideje kiszámíthatatlan (3).
Ajánlás az NVPF antitrombotikus profilaxisára (3. táblázat)
- Krónikus (intermittáló, perzisztens, permanens) NVPF (és pitvarlebegés) és magas rizikó esetén tartós kumarinkezelés indikált, úgy, hogy az INR 2-3 legyen. Aszpirinkezelés javasolt 65 év alatt, ha nincs rizikófaktor (A szint).
- Több mint egy mérsékelt rizikót jelentő faktor esetén kumarin (INR 2,0-3,0), míg legalább egy ilyen faktor esetén aszpirin adása javasolt (10) (C szint).
- Elektromos cardioversio előtt, ha az NVPF fennállása >48 óra, 3 héten át, a sinusritmus helyreállítása után legalább 4 hétig szükséges az orális antikoaguláns kezelés (C szint). A hagyományos prevenció alternatíváját jelenti a TEE-vezérelt cardioversio (C szint).
- 48 óránál rövidebb ideje fennálló NVPF esetén a cardioversio előtt és után közvetlenül antikoaguláns kezelés (iv. heparin vagy LMWH) ajánlott (C szint).
- A tervezett gyógyszeres cardioversio antitrombotikus profilaxisa megegyezik az elektromossal. A sinusritmus helyreállítása után, fenntartó antiarrhythmiás kezelés esetén is indokolt a krónikus antikoaguláns kezelés folytatása az AFFIRM tanulmány alapján (20a).
Antitrombotikus kezelés natív billentyűhibákban
Reumás mitralis billentyűhibában a szisztémás embólia veszélye közismerten magas. A legnagyobb kockázatot a mitralis stenosis (MS) és a pitvarfibrilláció (PF) kombinációja jelenti. A Framingham-vizsgálat (21) szerint a stroke-rizikót a PF MS-ben közel 18-szorosra növeli, míg a nem reumás PF közel 6-szorosra. A thromboemboliás rizikófaktorok között a PF után első helyen áll az anamnézisben szereplő embólia, főleg az első 6-12 hónapban. További rizikótényezők: az életkor, a balkamra-diszfunkció vagy a szívelégtelenség - akárcsak az NVPF-ben. A bal pitvar mérete kérdéses szerepet játszik, de az óriás pitvarok biztosan fokozzák a thromboemboliás rizikót sinusritmusban is. Az antikoaguláns kezelés védőhatása nyilvánvaló, de csak kis vizsgálatokból származnak adatok. Ezek szerint az antikoagulált betegekben az embóliaincidencia 6-25%-ról 0,8%-ra csökkent (22).
Infektív endocarditisben (IE) az embóliaforrás maga a vegetáció. Bár a mitralis pozíció az aortapozícióhoz képest fokozza az embóliarizikót, ez a különbség nem magyarázható a PF-fel. A vegetáció összetétele csak kevéssé tér el a thrombusétól, antitrombotikus kezeléssel mégsem lehet az embóliaveszélyt befolyásolni.
Ajánlás a natív billentyűhibák antitrombotikus profilaxisára (4. táblázat)
- Reumás mitralis billentyűhibánál indikált a tartós antikoaguláns kezelés (INR 2-3) paroxizmális vagy krónikus PF esetén, vagy ha az anamnézisben szisztémás embólia szerepel. Sinusritmusban ajánlott az antikoaguláns kezelés, ha a bal pitvari rövid átmérője meghaladja az 55 mm-t, vagy ha több komorbid tényező áll fenn ezen kívül is (életkor, a stenosis súlyossága). Az antikoaguláns kezelés kiegészíthető napi 100 mg aszpirin adásával, ha adekvát antikoaguláns kezelés ellenére embólia lép fel (22) (C szint).
- Mitralis billentyűprolapsus önmagában nem jelent antitrombotikus indikációt. Ebben az esetben aszpirin csak mással nem magyarázható TIA után ajánlott, napi 162,5-325 mg adagban. Antikoaguláns kezelés akkor indikált, ha a TIA az aszpirinkezelés ellenére ismétlődik, vagy stroke után, illetve PF esetén (C szint).
- Mitralis anulus kalcifikáció önmagában nem jelent antitrombotikus indikációt. Antikoaguláns kezelés csak PF esetén ajánlott (C szint).
- Aorta-billentyűhiba önmagában nem jelenti antitrombotikus kezelés indikációját.
- Natív billentyű IE-ben sinusritmus esetén az antitrombotikus kezelés kontraindikált. Antikoaguláns kezelés akkor jön szóba, ha a szisztémás embólia PF mellett lép fel, és pitvari thrombus igazolható (22).
Antitrombotikus kezelés műbillentyűs betegeknél
Thromboemboliás rizikó
A műbillentyűk alapvetően 2 csoportra oszthatók: mechanikus és biológiai műbillentyűkre. A biológiai billentyű rövidebb élettartamú, beültetését aortapozícióban a 65 év, mitralis pozícióban a 70 év feletti életkor, maga a tricuspidalis pozíció (lásd a billentyűműtétekről írt szakmai ajánlást) és az antikoaguláns kezelés elkerülhetősége indokolja. A mechanikus műbillentyűvel élő betegekben a leggyakoribb és legsúlyosabb szövődmény a thromboembolia, mely csak folyamatos és jól beállított antikoaguláns kezeléssel védhető ki. A már kialakult műbillentyű-trombózis kezelésében korábban csak a műtét, újabban a thrombolysis vagy az antitrombotikus kezelés módosítása jön szóba (23).
A thromboembolia a billentyűtípustól, lokalizációtól és az antikoaguláció minőségétől függően 0,2-1,8%/betegév (24). Kumarinkezelés nélkül még bileaflet típusú billentyűk esetén is igen magas lehet a thromboemboliás incidencia, ezen belül aortapozícióban 23%-ról számoltak be (25). Aortapozícióban egyéb rizikófaktorok nélkül a 2-3 közötti INR elegendő, és mitralis pozícióban sem számottevő az embóliarizikó-redukció fokozódása 3,5-es INR felett (26).
A thromboemboliát fokozó rizikófaktorok felsorolását az 5. táblázat tartalmazza (27).
Antitrombotikus kezelés mechanikus műbillentyűsöknél
Az antikoaguláns kezelés optimális beállítása műbillentyűs betegeknél a legfontosabb és a legnehezebb. Problémát jelent a műbillentyűs beteg nem kardiális műtéte, terhessége és az infektív endocarditise kapcsán követendő antitrombotikus stratégia is.
Gyermekeknél különösen nehéz az antikoaguláns kezelés beállítása: antikoaguláns kezelés nélkül a thromboembolia incidenciája még St. Jude-billentyű esetén is közel 6%/betegév, aszpirinkezeléssel pedig még aortapozícióban is 2-68%/betegév incidenciáról számoltak be (25).
Turpie híres tanulmánya (28) új szemponttal egészítette ki az antikoaguláns kezelést: kis adag aszpirin hozzáadásával a halálozás és az embóliaveszély anélkül csökkenthető, hogy a major vérzés előfordulása nőne.
Antitrombotikus kezelés biológiai műbillentyűsöknél és billentyűplasztika után
A nem mechanikus billentyűvel operált betegeknél is magas az embóliarizikó a posztoperatív endothelisatio helyreállásáig, ami kb. 3 hónapot tesz ki (29). Egyéb rizikótényezők jelenlétében (pitvarfibrilláció, embóliás anamnézis, balkamra-diszfunkció) az embóliarizikó hasonló a natív billentyűhibás betegekéhez.
Ajánlás műbillentyűs betegek antitrombotikus kezelésére (2, 30)
Mechanikus műbillentyű
Az ajánlást a 6. táblázat foglalja össze.
Antikoaguláns kezelés minden esetben kötelező. Az első 3 hónapban az INR 2,5-3,5 legyen (C szint). A cél INR eléréséig hagyományos heparin vagy testsúlyra számított, teljes adagú LMWH adása ajánlott (30).
A 3. hónap után aortapozícióban, rizikófaktor nélkül, bileaflet vagy Medtronic-Hall billentyű esetén az INR 2-3 legyen (A szint). Aortapozícióban pitvarfibrillációval, valamint mitralis pozícióban bileaflet és tilting disc billentyű esetén a cél INR 2,5-3,5.
A többi esetben (egyéb típusú billentyű vagy/és rizikófaktor) az INR 2,5-3,5 legyen (6. táblázat).
Biológiai műbillentyű
Az első 3 hónapban antikoaguláns kezelés (INR 2,5-3,5) javasolt. A továbbiakban, rizikófaktor nélkül, naponta 100 mg aszpirin, rizikófaktorral kumarin ajánlott: INR 2,0-3,0 (A szint).
Mitralis billentyűplasztika
Az antitrombotikus ajánlás egyezik a bioprotézisre előírtakkal.
Adekvát antitrombotikus terápia ellenére bekövetkező embólia
Az ajánlás lényege a cél INR emelése 1 fokozattal (2-3-ról 2,5-3,5-re, 2,5-3,5-ről 3,5-4,5-re), aszpirinnal nem kezelt betegeknél napi 100 mg aszpirin hozzáadása, csak aszpirint szedő betegeknél kumarin hozzáadása (INR 2-3).
Nem kardiális műtét
Az antikoaguláns kezelés leállítása műbillentyűs betegeknél 3,7-szeresre emeli a thromboemboliás rizikót (27). A műbillentyű-trombózis lassan, alattomosan alakul ki, és hónapokig tünetmentes maradhat, ami késlelteti a diagnózis felállítását és a megfelelő kezelést. Az antikoaguláns hatás leállítása a műtét előtt legalább 3 napos kumarinkihagyást igényel. Műtét után lehetőleg 24 órával az orális antikoaguláns kezelést újra kell kezdeni. A posztoperatív antikoaguláns hatás kialakulásához kb. 5 nap szükséges. Így összesen akár 1 hét inadekvát antikoaguláltsági állapottal kell számolni. Ez a megoldás (konvencionális stratégia) csak akkor engedhető meg, ha a thromboemboliás rizikó alacsony (aortapozíció, bileaflet típus, egyéb rizikófaktor hiánya). A magunk részéről az „agresszív stratégiát” tartjuk biztonságosnak.
Eszerint a beteget hospitalizálni kell, a műtét előtt heparininfúzióra kell átállítani, a műtét után heparininfúzióval egyidejű „átfedéses” kumarinkezelést kell adni. A műtét előtt 6 órával az iv. heparint le kell állítani.
Korábban műbillentyűs betegeknél, tapasztalatok hiányában, az LMWH-t a heparin helyettesítésére nem ajánlották (2, 27), jelenleg 3 kis prospektív tanulmány alapján (31-33) a heparininfúzió testsúlykg-ra illesztett napi kétszeri adagú LMWH-val helyettesíthető (30), de közvetlenül a műtét előtt érdemes infúziós heparin adására áttérni (6). Ez az ajánlás vonatkozik a pitvarfibrillációra is.
Foghúzáshoz kumarinleállítás nem szükséges és nem ajánlott; az INR 2-2,5 között legyen. Szívkatéterezésre ugyanez az ajánlás vonatkozik.
Antikoaguláns kezelés műbillentyűs beteg terhessége alatt és szüléskor
A műbillentyűs beteg terhessége aránylag ritkán fordul elő, de az antikoaguláns kezelés a terhesség alatt az anyára és a magzatra nézve is súlyos szövődményekkel járhat. Emiatt rendkívül fontos, hogy reproduktív korban levő nőknél a műbillentyű-beültetés időpontjának megválasztásában figyelembe vegyük a beteg reprodukciós terveit. A biológiai műbillentyű ugyan kiutat jelenthetne ebből a problémából a terhességet tervező nő számára, azonban ismert, hogy a terhesség akcelerálja a bioprotézis kalcifikációját, ezért idő előtti vagy akár sürgősségi reoperációhoz vezethet.
A magzati kockázat szempontjából a heparin előnyösebb a kumarinnál, mert nem jut át a placentán. A kumarin teratogén hatása a terhesség első trimeszterében, a 6-12. hét között érvényesül az esetek 4-10%-ában (26), bár 5 mg napi dózisnál kisebb warfarin- (vagy 2 mg Syncumar) dózis esetén az embryopathia veszélye csekély (34).
Az anyai kockázat kumarin esetén csak annyiban tér el a nem terhes nőkétől, hogy a terhesség alatt hiperkoagulabilitás alakul ki. A heparinkezelés csak infúziós módszerrel jelent megbízható antikoagulálást, de még ezzel is nehéz biztosítani a 2-szeresnél nagyobb APTI-értéket. A gyakorlatban ez a módszer nem is alkalmazható, a sc. beadásnál pedig legalább 35-40 000 E napi adagra lenne szükség. A sc. heparinnal kezelt terheseknél a műbillentyű-trombózis többszöröse a kumarinnal kezeltekének (35), a sokszor fatális műbillentyű-trombózis előfordulása elérheti a 15%-ot (36). Ugyanakkor a vérzés veszélye heparinnal nagyobb, mint kumarinnal. A tartós heparinadás osteoporosis és thrombopenia veszélyével is jár.
Az LMWH-k mellékhatásprofilja kedvezőbb, az adagolás is egyszerűbb, ezért a frakcionálatlan heparin alternatívája lehet testsúlyra illesztett adagolásban („full terápiás dózis”) (37).
A gyári alkalmazási előírások kumarin adását tiltják a terhesség alatt. Az anya védelmében már 1995-ben változtattak ezen a szemléleten az Európai Kardiológus Társaság ajánlásában (38), hasonló állásfoglalásra jutott a Mayo Klinika munkacsoportja (27) és legújabban az Amerikai Kardiológus Társaság is (2, 5b). Az új megközelítés megengedi kumarin adását az egész terhesség alatt az utolsó 2 hétig, amikor a szülés előtti heparinátállítás kezdődik. Az AHA/ACC-ajánlás (2) lényege, hogy teljes felvilágosítás után az anyára bízza a választást a 2 alternatíva között.
Az ACCP-ajánlás (37) szerint 2 megoldás lehetséges:
- az egész terhesség alatt sc. heparin vagy LMWH;
- a 13. hétig sc. heparin vagy LMWH, majd kumarin, később a 3. trimeszter közepétől ismét sc. heparin vagy LMWH.
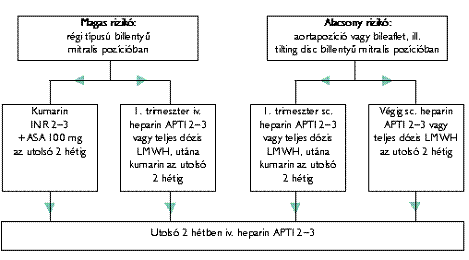
Ajánlás műbillentyűs terhes betegek antikoaguláns kezelésére (C szint)
Magas rizikójú nőnek (régi típusú műbillentyű mitralis pozícióban vagy embóliás anamnézis), ha nem kumarint választ, akkor az első trimeszterben infúziós heparint kell kapnia - úgy, hogy az APTI 2-3-szoros legyen -, vagy „full dózis” LMWH-t.
A kumarint választó betegek INR-értéke 2-3 között legyen 100 mg aszpirinnel kiegészítve a terhesség egész ideje alatt.
Alacsony rizikójú betegek kaphatnak az első trimeszterben vagy végig sc. heparint (2x17 500- 20 000 E) - úgy, hogy az APTI 2-3-szoros legyen - vagy teljes dózisú LMWH-t (1. ábra).
A várható szülés előtt, tehát a terhesség 36. hetében a kumarin leállítandó, és a szülésig intravénás heparint kell adni. Ha a szülés a kumarinkezelés alatt indul meg, császármetszés javasolt. A szülés után 4-6 órával kell az iv. heparin- és a Syncumar-kezelést megkezdeni. A Syncumar melletti szoptatás veszélytelen.
Infektív endocarditis
Az embólia előfordulása műbillentyű IE-ben 50-88% (22). Az antikoaguláns kezelés folytatása ezt nem befolyásolja, viszont emeli az intracranialis vérzés rizikóját; bármilyen kétélű fegyver is az antikoaguláns kezelés műbillentyű IE-ben, a jelenlegi álláspont az, hogy a kumarinkezelést folytatni kell. A várható műtét előtt heparinra kell áttérni (27). Aktív IE-ben azonban sürgős műtéti indikáció bármikor lehetséges, ezért instabil betegeknél a heparinra való átállás ajánlott.
Gyermekkori mechanikus műbillentyű antitrombotikus kezelése
Gyermekeknél is kötelező (39) az antikoaguláns kezelés mechanikus műbillentyű esetén. A cél INR 2,5-3,5, ill. a 2-3 cél INR szerinti kumarinkezelés napi 6-20 mg/kg aszpirinnel egészítendő ki. Adekvát antikoaguláns kezelés ellenére bekövetkező embólia után a kumarinkezelést ugyancsak napi 6-20 mg/kg aszpirinnel kell kiegészíteni.
Antikoaguláns kezelés akut myocardialis infarktusban (AMI) az intracardialis thromboembolia prevenciójára
AMI-ban az antikoaguláns kezelés a thrombolyticus terápia adjuváns kezelésének részét képezi. Ebben az ajánlásban azonban csak az intracardialis thromboembolia prevenciójával foglalkozunk.
AMI-ban a szisztémás embolisatio leggyakoribb megjelenési formája az ischaemiás stroke. Az embóliaforrás a bal kamra, a bal pitvar vagy mindkettő. A stroke gyakorisága anterior AMI-ban 2-6%. A bal kamrai thrombus anterior AMI-ban echokardiográfiás vizsgálatok szerint 40%-ban fordul elő, míg inferior AMI-ban ritka. A thrombus és az embólia az AMI első napjaiban-heteiben a leggyakoribb, de még évek múlva is előfordul. A thromboembolia rizikófaktorai: az extenzív - főleg anterior - AMI, a balkamra-diszfunkció, akut aneurizma, szívelégtelenség és pitvarfibrilláció. A heparinnal kezdett antikoaguláns kezelés a stroke előfordulását jelentősen csökkenti. Hasonló preventív antikoaguláns hatásról számoltak be a kis molekulatömegű dalteparinnal (7).
Ajánlás AMI intracardialis thromboemboliás profilaxisára (44)
Magas rizikójú betegek (anterior Q-infarktus, súlyos balkamra-diszfunkció [EF<35%], szívelégtelenség, szisztémás vagy pulmonalis thromboemboliás anamnézis, 2D echóval kimutatott bal kamrai thrombus, pitvarfibrilláció) sztreptokináz (SK) nélkül kezdettől, SK-kezelés esetén azt 4 órával követően iv. infúziós heparint kapjanak APTI (1,5-2-szeres) szerint, vagy testsúlykilogrammra illesztett LMWH-t, majd átfedéssel kumarint (INR 2-3) legalább 3 hónapig. A kumarinkezelés 3 hónap után is folytatandó, ha a rizikófaktorok akkor is fennállnak (balkamra-diszfunkció, bal kamrai thrombus, pitvarfibrilláció, embóliás anamnézis). Az antikoaguláns kezelés mellett aszpirint nem kell adni (C szint).
Antikoaguláns kezelés szívelégtelenségben
Szívelégtelenségben, súlyos balkamra-diszfunkció, ill. dilatatív cardiomyopathia esetén a jelenlegi álláspont szerint sinusritmusban nem indokolt a rutinszerű antikoaguláns kezelés (40). Szívelégtelenségben a thromboembolia gyakorisága a nagy tanulmányok alapján (V-HeFT-1 és V-HeFT-2, SOLVD, AIRE, SAVE) 1,6-2,5%/betegév incidenciát mutat, bár dilatatív cardiomyopathiában 20%-ot írtak le, sőt a klinikai tüneteket nem okozó thromboembolia ennél gyakoribb is lehet (41). Az említett nagy szívelégtelenség-tanulmányok retrospektív analízise alapján ischaemiás vagy dilatatív cardiomyopathiában sem az antikoaguláns, sem az anti-thrombocytakezelés nem csökkentette a thromboemboliás rizikót (42), prospektív randomizált vizsgálat még nem történt. Bal kamrai thrombus, korábbi thromboembolia, pitvarfibrilláció esetén egyértelmű az antikoaguláns kezelés indikációja (INR 2-3) (43).
Ajánlás a szívelégtelenség antitrombotikus profilaxisára (47)
Sinusritmusban, balkamra-diszfunkció esetén az antikoaguláns kezelés, evidencia hiányában, egyénileg mérlegelendő.
Antitrombotikus profilaxis egyéb esetekben
Thrombocytaaggregáció-gátló kezelés indokolt aortaplakk esetén és a mitralis billentyűprolapsus szekunder prevenciójában (22).
Nem jelent önmagában antitrombotikus kezelési indikációt a mitralis anulus kalcifikáció és a mitralis billentyűprolapsus (22).
Kérdéses az antitrombotikus kezelés nyitott foramen ovale, pitvari septumaneurysma, az ún. komplex aortaatheromák eseteiben.
Nyitott foramen ovale a normál egyének mintegy 20%-ában kimutatható. Fiatal egyének kriptogén stroke-ja esetén előfordulása akár 50% is lehet, ami ok-okozati összefüggés gyanúját kelti (45). A stroke okaként ez azonban csak mint a paradox embóliát lehetővé tevő „conduit” fogható fel, tehát vénás thromboemboliás betegséggel együtt. Paradox embólia elsősorban magas jobbszívfél-nyomás esetén jön szóba, akut pulmonalis embolia és krónikus thromboemboliás pulmonalis hipertónia kapcsán (46).
A pitvari septumaneurysma elvileg az aneurizma bal oldali felszínén kialakuló thrombus miatt lehetne embóliaforrás, ezt azonban eddig ritka kivételektől eltekintve nem lehetett kimutatni, inkább nyitott foramen ovaléval kombinálva jelenthet forrást (48), tehát a nyitott foramen ovaléra vonatkozó megállapítások vonatkoznak pitvari septumaneurysmára is.
Az aortaatheromák önálló rizikótényező szerepét pitvarfibrillációban a SPAF III. tanulmány igazolta (11).
A komplex aortaplakk (>4 mm vastag vagy mobilis komponensek) prediktív rekurrens stroke-ra (49). Sinusritmusban levő betegeknél azonban nincs bizonyíték arra, hogy az antikoaguláns kezelés hatékonyabb lenne, mint a thrombocytaaggregáció-gátló kezelés az atherothromboticus stroke szekunder prevenciójában, sőt az eddig végzett egyetlen tanulmányt a major vérzések előfordulásának emelkedése miatt idő előtt le kellett zárni (50).
Ajánlás az egyéb embóliaforrások antitrombotikus profilaxisára (C szint)
Aortaplakk esetén aszpirinkezelés javasolt. Az aortaív komplex atheromáinak (mobilis, >4 mm) antikoaguláns kezelése ajánlott (22).
A mitralis billentyűprolapsus, a meszes mitralis anulus, a nyitott foramen ovale és a pitvari septumaneurysma nem jelent primer prevenciós antitrombotikus indikációt. A szekunder prevencióban vénás trombózis vagy pulmonalis embolia igazolása után antikoaguláns kezelés indikált, ha a nyitott foramen ovale sebészi vagy katéteres zárása nem történik meg (22).
A mitralis (esetleg aorta-) billentyűn és a műbillentyűkön látható szálcsák („strand”) fibrinszálaknak felelhetnek meg, embóliával való összefüggésük nem bizonyított, terápiás konzekvenciájuk ismeretlen (45).
Thromboemboliás betegségek kezelése, intracavitalis thrombus
Intracavitalis thrombust találhatunk véletlen vizsgálat során, infarktus után (bal kamrai), embóliaforrás keresése során (bal pitvari, paradox, kamrai) vagy cardioversio előtt (fülcse). Szívelégtelenségben a fülcsethrombus legalább olyan gyakori, mint a bal kamrai.
Kezelése
Tartós antikoaguláns kezelés (Syncumar vagy heparinnal bevezetett Syncumar) (C szint). Az antikoaguláns kezelés „feloldhatja” a thrombust, mivel ezáltal a spontán fibrinolízis folyamatosan meghaladja a thrombusappozíciót. Thrombolysis kontraindikált.
Műbillentyű-trombózis
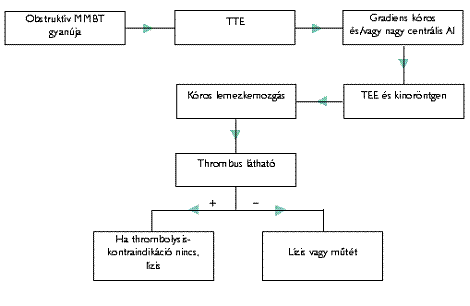
A műbillentyű-trombózis lehet obstruktív vagy nonobstruktív. Az obstrukciót a lemezkemozgás korlátozottsága jelenti (51). Az obstrukció bileaflet műbillentyű esetén gyakran parciális, amikor csak az egyik leaflet mozgása korlátozott. Mindkét esetben a műbillentyű-trombózis embóliaforrás is lehet, a nonobstruktív forma csak embóliában manifesztálódik vagy tünetmentes. TTE-vel műbillentyű-obstrukcióra (trombózisra) utal a nyomásgradiens növekedése, aortapozícióban ehhez járul még a jelentős centrális regurgitatio megjelenése. A diagnózisban a TEE a választandó módszer (23), de a vegetációtól, illetve a pannustól való elkülönítés ezzel sem megbízható.
Aortapozícióban a lemezkemozgás megítélésére a röntgen képerősítős átvilágítás (kinoröntgen) megbízhatóbb lehet a TEE-nél, de az obstrukció okát csak a TEE mutatja ki (52). A műtéti kezelés magas mortalitása (akár 69%) miatt került előtérbe a fibrinolízis. A fibrinolízis sikeraránya 80% felett van, de a balszívfél-műbillentyűk esetén a thromboemboliás rizikó 12%, a stroke előfordulása ebből 3-10%, a halálozás 6%. A rizikót növeli az obstrukció (51) és feltehetően a thrombus mérete. Nonobstruktív trombózisban a fibrinolízis sikeraránya közel 100%, a szövődmények előfordulása gyakorlatilag nulla (51, 53).
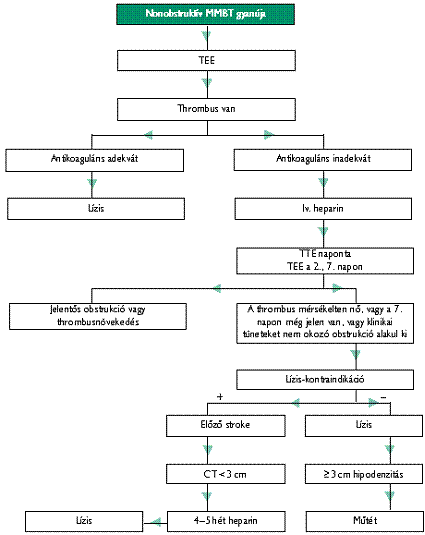
Nonobstruktív trombózisban az első lépés a heparininfúzió lehet, melyet sikertelenség esetén váltunk át fibrinolízisre. Sikertelen fibrinolízis után a reoperáció elvégezhető 24 óra múlva, vagy FFP adása után azonnal.
A thrombolysis kontraindikációit a 7. táblázat tartalmazza (23). A terhesség nem jelent kontraindikációt, sőt a magzat szempontjából biztonságosabb, mint a reoperáció.
A thrombolysis eredményének monitorozására obstrukció esetén a Doppler-echokardiográfia, nonobstruktív esetekben a TEE szolgál. A Doppler-echokardiográfiát 6 óránként, a TEE-t 24 óránként érdemes végezni.
Ajánlás műbillentyű-trombózis kezelésére (23)
Thrombolysis ajánlott kontraindikáció hiányában (2., 3. ábra)
- tricuspidalis műbillentyű-trombózis minden esetében;
- a bal szívfél obstruktív műbillentyű-trombózisa esetén;
- nonobstruktív trombózis esetén, sikertelen heparininfúzió után.
A thrombolysis módja
- Sztreptokináz 250 000 E bolusz, majd 100 000 E/óra a fibrinolízis sikeréig vagy maximum 72 órán át. Alternatívák: urokináz 4400 E/kg bolusz, majd 2200 E/kg/óra vagy rtPA 100 mg infúzió 2 óra alatt, vagy 3 ME sztreptokináz 2 óra alatt.
Laboratóriumi kontroll: - legalább 12 óránként fibrinogénszint, ha 0,5 g/l alá esik, a kezelés csak FFP hozzáadásával folytatható;
- a kezelés kezdetétől számított 24. órában trombinidő- és APTI-mérés, ha litikus állapot nem igazolható, a kezelést abba kell hagyni (23).
Antikoaguláns kezelés ajánlott
- Nonobstruktív bal szívfél műbillentyű-trombózisban, ha a thrombolysis kontraindikált vagy első lépésben esetleges thrombolysis előtt (50);
- sikeres thrombolysis után átfedéses kumarinnal együtt.
Az antikoaguláns kezelés módja
- Heparininfúzió, úgy, hogy az APTI 2-3-szoros legyen.
A thrombolysis szövődményeinek kezelése
- Perifériás embólia esetén a thrombolysis folytatása.
- Stroke esetén a thrombolysis azonnali leállítása, sürgős koponya-CT a vérzés kizárására, ha a vérzés kizárható, 3 órán belül rtPA adása (0,9 mg/kg, max. 90 mg infúzió 1 óra alatt, úgy, hogy az adag 10%-át boluszban adjuk) (45).
1. táblázat Rizikóstratificatio NVAF-ben
| Magas rizikó | Mérsékelt rizikó |
|---|
| Stroke/TIA után | diabetes mellitus |
| Hipertóniás anamnézis | coronariabetegség |
| Balkamra-diszfunkció | |
| >75 év életkor | 65-75 év életkor |
2. táblázat Stroke-incidencia az életkor és a rizikófaktorok függvényében
| Életkor (év) | Rizikófaktor | Évi incidencia (%) |
|---|
| <60 | 0 | 0 |
| <65 | 0 | 1,0 |
| ≥1 | 4,9 |
| 65-75 | 0 | 4,3 |
| ≥1 | 5,7 |
| >75 | 0 | 3,5 |
| ≥1 | 8,1 |
Rizikófaktorok: előző stroke vagy TIA, szívelégtelenség, hipertónia, diabétesz
3. táblázat Antitrombotikus profilaxis nonvalvularis pitvarfibrillációban
| Életkor | RF | Kezelés |
|---|
| <65 év | 0 | ASA 100 mg |
| ≥65 év | ≥1 magas | AC INR 2-3 |
| 65-75 év | >1 mérsékelt | AC INR 2-3 |
| 65-75 év | ≤1 mérsékelt | ASA 100 mg |
RF = rizikófaktor; magas és mérsékelt RF felsorolása az 1. táblázatban
AC = antikoaguláns, ASA = aszpirin
4. táblázat Antitrombotikus profilaxis natív billentyűhibákban
| | Kezelés |
|---|
Reumás mitralis billentyűhiba- + PF
- + SR, de van:
embóliás anamnézis
vagy bal pitvar >55 mm
vagy súlyos MS
vagy egyéb RF
| AC INR 2-3 |
| MBP | 0 |
| MBP + TIA után | ASA 160-325 mg |
| Mitralis anulus kalcifikáció | 0 |
| Aorta-billentyűhiba | 0 |
| IE | 0 |
PF = pitvarfibrilláció, SR = sinusritmus,
MPB = mitralis billentyűprolapsus, IE = infektív endocarditis
5. táblázat Thromboemboliás rizikófaktorok műbillentyűs betegeknél
- Első generációs golyós vagy billenőszelepes billentyűk (Starr-Edwards, Björk-Shiley, Omniscience)
- Kettős lokalizáció
- Mitralis pozíció
- Pitvarfibrilláció
- Balkamra-diszfunkció
- Embóliás anamnézis
- Hiperkoagulabilis állapot
- Balpitvar-tágulat
6. táblázat Antitrombotikus kezelés műbillentyűs betegeknél
| • Első 3 posztoperatív hónap | INR 2,5-3,5 |
| • Mechanikus műbillentyű >3 hónap | |
| - aortabileaflet vagy Medtronic-Hall, rizikófaktor nélkül | 2,0-3,0 |
| - mitralis bileaflet vagy tilting disc | 2,5-3,5 |
| - aortabileaflet és pitvarfibrilláció | 2,5-3,5 |
| - régi típusú billentyű | 2,5-3,5 |
| - bármilyen típusú billentyű, rizikófaktorokkal | 2,5-3,5 |
| • Biológiai billentyű >3 hónap | |
| - rizikófaktor nélkül | 100 mg aszpirin |
| - rizikófaktorokkal (pitvarfibrilláció, embóliaanamnézis, thrombus a műtétnél) | 2,0-3,0 |
7. táblázat A thrombolysis kontraindikációi műbillentyű-trombózisban
- Abszolút kontraindikációk:
- aktív belső vérzés;
- agyvérzés az anamnézisben;
- koponyatrauma a kezelés előtt közvetlenül vagy neoplazma;
- 200/120 Hgmm-nél magasabb vérnyomás,
- diabéteszes haemorrhagiás retinopathia.
- Relatív kontraindikációk:
- 10 napon belül gastrointestinalis vérzés;
- 10 napon belüli nem komprimálható artériás punkció;
- 2 hónapon belüli ischaemiás agyi történés;
- infektív endocarditis;
- kezeletlen súlyos hipertónia;
- nagy tömegű thrombus a bal pitvarban vagy a műbillentyűn;
- 2 héten belüli nagy műtét vagy trauma;
- ismert vérzékenység;
- terhesség.
1. ábra A mechanikus műbillentyűvel élő nők antikoaguláns kezelése a terhesség alatt
2. ábra Műbillentyű-thrombolysis algoritmusa obstruktív trombózis esetén
MMBT = mechanikus műbillentyű-trombózis
3. ábra Műbillentyű-trombózis kezelésének algoritmusa nonobstruktív trombózis esetén
Irodalom
1. Sixth ACCP Consensus conference on antithrombotic therapy (2001). Chest. 2001;119:1S-370S.
2. Bonow, R. O., Carabello, B., DeLeon, A. C. et al.: ACC/AHA guidelines for the management of patients with valvular heart disease. J. Am. Coll. Cardiol. 1998;32:1486-588.
3. Lévy, S., Breithardt, G., Campbell, R. W. F. et al. on behalf of the Working Group on Arrhythmias of the European Society of Cardiology. Atrial fibrillation: current knowledge and recommendations for management. Eur. Heart J. 1998;19:1294-1320.
4. Cheitlin, M. D., Alpert, J. S., Armstrong, W. F. et al.: ACC/AHA guidelines for the clinical application of echocardiography: executive summary. A report of the ACC/AHA Task Force on Practice Guidelines. J. Am. Coll. Cardiol. 1997;29:862-79.
5. Magyar Thrombosis és Haemostasis Társaság: A thromboemboliák megelőzése és kezelése. Magyar konszenzus nyilatkozat 1998. Gyógyszereink. 1995/5. Supplementum.
5/a. Barcellona D., Vannini M.L., Fen L. et al.: Warfarin or acenocoumarol: which is better in the management of oral anticoagulants? Thrombosis and Haemostasis 1998;80:899-902.
5b. Hirsh J, Fuster V, Ansell J, Halperin JL. AHA/ACC foundation guide to warfarin therapy J Am Coll Cardiol 2003;41:1633-52.
6. Ansell, J., Hirsch, J., Dalen, J. et al.: Managing oral anticoagulant therapy. Chest. 2001;119:22S-38S.
6a. Stroke prevention with the oral direct thrombin inhibitor ximelagatran compared with warfarin in patients with non-valvular atrial fibrillation (SPORTIF III): randomised controlled trial. Lancet 2003;362:1691-98.
7. Kontry, F., Dale, J., Abilgaard, U. et al.: Randomized trial of low molecular weight heparin (dalteparin) in prevention of left ventricular thrombus formation and arterial embolism after acute anterior myocardial infarction the Fragmin in Acute Myocardial Infarction (FRAMI) Study.J. Am. Coll. Cardiol. 1997;30:962-9.
8. Montalescat, G., Polle, V., Collet, J. P. et al.: Low molecular weight heparin after mechanical heart valve replacement. Circulation. 2000;101:1083-6.
9. Laupacis, A., Boysen, G., Connolly, S. et al.: Risk factors for stroke and efficacy of antithrombotic therapy in atrial fibrillation. Analysis of poled data from five randomized controlled trials. Arch. Intern. Med. 1994;154:1449-57.
10. Albers, G., Dalen, J., Laupacis, A. et al.: Antithrombotic therapy in atrial fibrillation. Chest. 2001;119:194S-206S.
11. Zabalgoitia, M., Halperin, J. L., Pearce, L. A. et al.: Transesophageal echocardiographic correlates of clinical risk of thromboembolism in nonvalvualr atrial fibrillation. J. Am. Coll. Cardiol. 1998;31:1622-6.
12. Petersen, P., Boysen, G., Godtfredsen, J. et al.: Placebo-controlled, randomised trial of warfarin and aspirin for prevention of thromboembolic complications in chronic atrial fibrillation: the Copenhagen AFASAK study. Lancet. 1989;1:175-8.
13. Stroke Prevention in Atrial Fibrillation Study. Final results. Circulation. 1991;84:527-39.
14. Boston Area Anticoagulation Trial for Atrial Fibrillation Investigators. The effect of low-dose warfarin on the risk of stroke in patients with nonrheumatic atrial fibrillation. N. Engl. J. Med. 1990;323:1505-11.
15. Connolly, S. J., Laupacis, A., Gent, M. et al. for the CAFA Study Co-investigators: Canadian Atrial Fibrillation Anticoagulation (CAFA) Study. J. Am. Coll. Cardiol. 1991;18:349-55.
16. Ezekowitz, M. D., Bridgers, S. L., James, K. E. et al. for the Veteran Affairs Stroke Prevention in Nonrheumatic Atrial Fibrillation Investigators. Warfarin in the prevention of stroke associated with nonrheumatic atrial fibrillation. N. Engl. J. Med. 1992;327:1406-12.
17. The European Atrial Fibrillation Trial Study Group: Optimal oral anticoagulant therapy in patients with nonrheumatic atrial fibrillation and recent cerebral ischemia. N. Engl. J. Med. 1995;333:5-10.
18. Hart, R. G., Benavente, O., McBride, R. and Pearce, L. A.: Antithrombotic therapy to prevent stroke in patients with atrial fibrillation: a metaanalysis. Ann. Intern. Med. 1999;131:492-50.
19. Gallus, A. S., Baker, R. I., Chong, B. H. et al. On behalf of the Australasian Society of Thrombosis and Hemostasis. Consensus guidelines for warfarin therapy. M.J.A. 2000;172:600-5.
20. Klein, A. L., Grimm, R. A., Black, I. W. et al.: Cardioversion guided by transesophageal echocardiography: the ACUTE pilot study Ann. Intern. Med. 1997;126:200-9.
20a. AFFIRM Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N Engl J Med 2002;347:1825-33.
21. Wolf, P. A., Abbott, R. D., Kannel, W. B.: Atrial fibrillation: a major contributor to stroke in the elderly. Arch. Intern. Med. 1987;147:1561-4.
22. Salem, D. N., Daudelin, D. H., Levine, H. J. et al.: Antithrombotic therapy in valvular heart disease. Chest. 2001;119:207S-219S.
23. Lengyel, M., Fuster, V., Keltai, M. et al.: Guidelines for management of leftsided prosthetic valve thrombosis: a role for thrombolytic therapy. J. Am. Coll. Cardiol. 1997;30:1521-6.
24. Cannegieter, S. C., Rosendall, F. R.: Thromboembolic and bleeding complications in patients with mechanical heart valve prosthesis. Circulation. 1994;89:635-41.
25. Stein, P. D., Alpert, J. S., Dalen, J. E. et al.: Antithrombotic therapy inpatients with mechanical and biological prosthetic heart valves. Chest. 1998;114:602S-610S.
26. Acar J., Iung B., Boissel, J. P. et al.: AREVA: multicenter randomised comparison of low-dose versus standard dose anticoagulation in patients with mechanical prosthetic heart valves. Circulation. 1996;94:2107-12.
27. Tiede, D. J., Nishimura, R. A., Gastinean, D. A. et al.: Modern management of prosthetic valve anticoagulation. Mayo Clin. Proc. 1998;73:665-80.
28. Turpie, A. G. G., Gent, M., Laupacis, A. et al.: A comparison of aspirin with placebo in patients treated with warfarin after h eart-valve replacement. N. Engl. J. Med. 1993;329:524-9.
29. Heras, M., Chesebro, J. H., Fuster, V. et al.: High risk of thromboemboli early after bioprosthetic cardiac valve replacement. J. Am. Coll. Cardiol. 1995;25:1111-9.
30. Stein, P. D., Alpert, J. S., Bussey, H. I. et al.: Antithrombotic therapy in patients with mechanical and biological prosthetic heart valves. Chest. 2001;119:220S-227S.
31. Johnson J., Turpie, A. C. G.: Temporary discontinuation of oral anticoagulants: role of low molecular weight heparin. Thromb. Haemost. 1999;82(Suppl):62-63.
32. Tinmouth, A., Kovács, M. J., Cruickshank et al.: Outpatient peri-operative and peri-procedure treatment with dalteparin for chronically anticoagulated patients at high risk for thromboembolic complications. Thromb. Haemost. 1999;82(Suppl.):662.
33. Spandorfer, J. M., Lynch, S., Weitz, H. H. et al.: Use of enoxaparin for the chronically anticoagulated patient before and after procedures. Am. J. Cardiol. 1999;84:478-80.
34. Vitale, N., DeFeo, M., DeSanto, L. S. et al.: Dose-dependent fetal complications of warfarin in pregnant women with mechanical heart valves. J. Am. Coll. Cardiol. 1999;33:1637-41.
35. Sharouni, E., Oakley, C. M.: Outcome of pregnancy in women with valve prostheses. Br. Heart J. 1993;71:196-201.
36. Elkayam, U.: Pregnancy through a prosthetic heart valve. J. Am. Coll. Cardiol. 1999;33:1642-5.
37. Ginsberg, J. S., Greer, I., Hirsh, J.: Use of antithrombotic agents during pregnancy. Chest. 2001;119:122S-131S.
38. Gohlke-Barwolf, C., Acar, J., Burckhardt, D. et al. (Ad Hoc Committee of the Working Group on Valvular Heart Disease, European Society of Cardiology). Guidelines for prevention of thromboembolis events in valvular heart disease. J. Heart Valve Dis. 1993;2:398-410.
39. Michelson, A. D., Bovill, E., Monagle, P., Andrew, M.: Antithrombotic therapy in children. Chest. 1998;114:758S-769S.
40. Hardmann, S. M. C., Cowie, M. R.: Szívbetegek antikoaguláns kezelése. BMJ Magyar kiadás. 1999;3:161-7.
41. Schmidt R., Fazekas F., Offenbacher H. et al.: Brain magnetic resonance imaging and neuropsychologic evaluation of patients with idiopathic dilated cardiomyopathy. Stroke. 1991;22:185.8.
42. Garg, R. K., Gheorghiade, M., Jafri, S. M.: Antiplatelet and anticoagulant therapy in the prevention of thromboembolia in chronic heart failure. Progr. Cardiovasc. Dis. 1998;41:225-36.
43. Committee on evaluation and management of heart failure: report of the American College of Cardiology/American Heart Association task force on practice guidelines. J. Am. Coll. Cardiol. 1995;26:1376-98.
44. Cairns, J. A., Théroux, P., Lewis, H. D. et al.: Antithrombotic agents in coronary artery disease. Chest. 2001;119:228S-252S.
45. Albers, G. W., Amarenco, P., Easton, J. D. et al.: Antithrombotic and thrombolytic therapy for ischemic stroke. Chest. 2001;119:300S-320S.
46. Lengyel, M.: The role of transesophageal echocardiography in the management of patients with acute and chronic pulmonary thromboembolism. Echocardiography. 1995;12:359-66.
47. Remme W. J., Swedberg K.: Guidelines for the diagnosis and treatment of chronic heart failure. Eur. Heart J. 2001;22:1527-1560.
48. Mügge A., Daniel W. G., Angermann C. et al.: Atrial septal aneurysm in adult patients. A multicenter study using transthoracic and transoesophageal echocardiography. Circulation 1995;91:2785-92.
49. The French Study of Aortic Plaques in Stroke Group. Atherosclerotic disease of the aortic arch as a risk factor for recurrent ischemic stroke.
N. Engl. J. Med. 1996;334:1216-21.
50. The Stroke Prevention in Reversible Ischemia Trial (SPIRIT) Study Group: A randomized trial of anticoagulants versus aspirin after cerebral ischemia of presumed arterial origin. Ann. Neurol. 1997;42:857-65.
51. Lengyel M., Végh G., Vándor L.: Thrombolysis is superior to heparin for nonobstructive mitral mechanical valve thrombosis. J. Heart Valve Dis. 1999;8:167-73.
52. Montorsi P., Cavoretto D., Repossini A. et al.: Valve design characteristics and cinefluoroscopic appearance of five currently available bileaflet prosthetic valves. Am. J. Cardiac. Imag. 1996;10:29-41.
53. Lengyel M., Vándor L.: The role of thrombolysis in the management of left-sided prosthetic valve thrombosis: a study of 85 cases diagnosed by thransesophageal echocardiography. J. Heart Valve Dis. 2001;10:636.
Megújítva: 2004. február 6-án





