A „dialysis adequacy” kifejezést a dialízis dózisának meghatározására találták ki, és általában ma is erre használják. Keresve azt az anyagot, amelynek eltávolítása markere lehetne a kezelés effektivitásának, az urea került a megfigyelések középpontjába. Megalkották az urea kinetikus modellt (UKM), amelyben a Kt/V formula fejezte ki az urea eltávolításának mértékét (K a dializátor urea clearance-e, t a kezelési idő percben, V az urea megoszlási tömege kg-ban).
Az adekvát dialízisdózis általában egy minimális célérték, amelynek elérésére törekedni kell minden egyes kezelés során.
Az urémiás toxikus tünetek kialakulásában számos vegyület felelőssége felmerült.
Tágabb értelemben az adekvát dialízis nem csupán a megfelelő dózis elérését jelenti, hanem a folyadékbalansz, a vérnyomás, a renalis anémia, a Ca-P anyagcserezavar korrekt kontrollját is. Feltétele az adekvát kezelésnek a biokompatibilis membránok, a high-flux dializátorok (indikációk szerint), továbbá a minőségi, nagy tisztaságú dializálóoldat alkalmazása.
Az összes felsorolt feltételeknek való megfelelés, a dialízis dózisának a célértéket meghaladó teljesítése, az egyénre szabott kezelések kivitelezése - modern technikával és képzett személyzettel - az optimális dialízis megvalósulását jelentheti.
Az urea eltávolításának a mérése a leghasználhatóbb marker a kis molekulasúlyú toxikus anyagok közül.
Bizonyítottság: B
A HD dózist a posztdialízis urea reboundra ekvilibrált Kt/V (eKt/V) értékkel kell megadni, mégpedig a regionális véráramlás kétkompart-mentes („two-pool”) urea kinetikus modell lapján.
AV-fisztula vagy AV-graft esetén:
A single-pool Kt/V-t (spKt/V) az egykompart-mentes formális urea kinetikus modell segítségével határozhatjuk meg (szoftver). Ennek hiányában világszerte elfogadott és a legkorrektebb alternatív lehetőségnek tartott számítás Dangirdas természetes alapú logaritmusos egyenletével történhet:
Az urea kinetika mérésén alapuló HD dózis krónikus HD betegeknél korrelál a morbiditási és a mortalitási mutatókkal - számos szerző véleménye szerint. Ez az összefüggés a legkifejezettebb a spKt/V 0,7-1,4 között, de vannak, akik magasabb értékeknél is pozitív korrelációt észleltek. Az UKM alkalmazását illetően sokan szkeptikusak, de vitathatatlan érdeme, hogy rávilágított a dialízis dózisának fontosságára, és bizonyos, hogy az „aluldializáltság” leküzdésével egyes betegcsoportok túlélését javította.
A javasolt módszerek között első helyen a formális urea kinetikus modell szoftvere által számított spKt/V (a zárás után 30 perccel vett posztdialízis BUN mérése esetén eKt/V) áll. A klinikai gyakorlatban azonban nagyon bevált a spKt/V (ezen keresztül az eKt/V) becslése a logaritmikus formula alapján.
A magyarországi gyakorlatban is ezt ajánljuk, ill. az ebből számított eKt/V értéket.
Egyszerű, gyakran használt érték a dialízisdózis kiszámítására. 0,6-1,3 spKt/V értékek között az URR lineáris összefüggést mutat a Kt/V-vel, magasabb Kt/V-nél az összefüggés exponenciális.
Az URR ajánlott minimális értéke több irányelv szerint is 65%. Ez kb. 1,2 spKt/V-nek felel meg (régebbi ajánlások), ezért ma a 70-75% közötti URR elérése javasolható.
A 2-mikroglobulin markere lehet az MM és egyéb peptidek eltávolításának.
Bizonyítottság: B
A MM eltávolításához high-flux membránok használata szükséges. A hatást javítja a konvektív transzport fokozása, a kezelés idejének vagy frekvenciájának növelése.
Bizonyítottság: B
A 2-mikroglobulin könnyen mérhető, ezért eltávolításának kvantifikációjára több módszert is kidolgoztak (redukciós ráta, átlagos
2-mikroglobulin mérése a dializátumban), a mérés költségei azonban nem teszik lehetővé széles körű klinikai alkalmazását. A többi MM-markerrel még kevesebb a tapasztalat.
Ha a betegnek még van saját veseműködése (Kr), akkor azt számításba véve és hozzáadva a dialízissel eltávolított urea mennyiségét reprezentáló eKt/V-t, kiszámíthatjuk a totális urea clearance-t (KT) vagy a hasonló értelemben használt totális frakcionális clearance-t (KTV).
A HD kezelés hatékonyságának megítélése szempontjából alapvető fontosságú a pre- és posztdialitikus vérminta vétele, ezért standard metodikát kell alkalmazni.
Bizonyítottság: A
A kivitelezett dialízisdózis ellenőrzése havonta ajánlott.
Bizonyítottság: B
Ha a kivitelezett dialízisdózis nem elégséges, keresni kell az okait.
Bizonyítottság: B
A pre- és különösen a posztdialízis ureavérminta vételekor gyakori a hibalehetőség, ezért az EBPG az alábbi technikát javasolja:
A standard HD dózis heti 3x4 óra. Ez a minimumidő akkor is kívánatos, ha a minimális Kt/V rövidebb kezelésekkel is elérhető.
Bizonyítottság: B
A kezelési időt és/vagy a gyakoriságot emelni kell azon betegeknél, akiknek cardiovascularis problémáik vannak, vagy instabil hemodinamikai állapotok jellemzik őket (különösen gyakori problémák ezek időskorban).
Bizonyítottság: B
Úgy tűnik, hogy a kezelési idő önmagában is javítja a toxikus anyagok eltávolítását - még azonos Kt/V eredmények esetén is - különösen igaz ez a középmolekulákra.
A legjobb túlélést olyan betegcsoportoknál figyelték meg, ahol a legnagyobb dózist a leghosszabb kezelési idővel alkalmazták.
E követelményeknek csak a 2, ill. 3 lumenű centrális vénakanülök felelnek meg.
Az alacsony szövődményráta és a hosszú használhatóság miatt elsősorban a v. jugularis interna kanülálása javasolt.
Bizonyítottság: B
Kerülni kell a v. subclavia kanülálását olyan betegek esetén, akik távlatokban tartós vérnyerési hely kialakítására szorulnak.
Bizonyítottság: A
V. femoralis kanült csak ágyban fekvő betegnél, legfeljebb 5 nap időtartamra javasolt használni, a kanül hossza legalább 19 cm legyen.
Bizonyítottság: B Fentiek miatt a v. femoralis primer kanülálása csak az egyéb kanülálásban jártas személyzet hiányában javasolt.
Bizonyítottság: C
A v. subclavia és v. femoralis esetén a trombotikus kockázat csökkenthető puha szilikon, illetve bioflex kanülök alkalmazásával.
Bizonyítottság: C
Vena jugularis interna, ill. vena subclavia kanülálása, illetve kanülálási kísérlete után mellkas-röntgenvizsgálat elvégzése kötelező.
Bizonyítottság: C
Célszerű primeren olyan kanült választani, mely a végleges vérnyerési hely használatba vételéig használható marad.
Bizonyítottság: C
A dialíziskanült célszerű csak dialízisre használni.
Bizonyítottság: B
Fentiek miatt a kritikus állapotú, intenzív osztályon kezelt beteg számára előnyös lehet 3 lumenű kanülök alkalmazása.
Bizonyítottság: C
A katéter exit site kötözésekor a személyzet és a beteg viseljen maszkot.
Bizonyítottság: C
Porózus ragtapasz használata ajánlott, mindenképpen szükséges az elzáró ragtapaszok kerülése.
Bizonyítottság: B
A nazális Staphylococcus aureus hordozók szűrése és Mupirocinnal történő kezelése javasolt.
Bizonyítottság: C
Áthidaló vérnyerés (bridge access)
A tunnelizált kétlumenű katéterek és ezek variánsa, az Ash Split katéter jelentősen hosszabb ideig használható az ideiglenes katétereknél.
Bizonyítottság: A
A speciálisan a v. jugularis kanülálására tervezett előre hajlított katéterek használhatósági ideje és szövődményrátája azonos, illetve bizonyos körülmények között jobb értéket mutat, mint a tunnelizált katétereké.
Bizonyítottság: B
Fenti katétertípusokkal elérhető, hogy a primer kanül használható maradjon a végleges vérnyerési hely kialakításáig.
Tartós vérnyerés
A választandó stratégia a végleges vérnyerési hely kialakítására az alábbi.
Az AV-fisztulát 20-25 ml/min GFR-értéknél célszerű elkészíteni, így a dialízis kezdése előtt elegendő idő áll rendelkezésre a fisztula éréséhez.
Bizonyítottság: A
Elsősorban a csuklótáji (a. radialis - v. cephalica) natív fisztula használata javasolt.
Bizonyítottság: A
Másodsorban könyöktáji (a. brachialis - v. cephalica) natív fisztula kialakítása javasolt.
Bizonyítottság: B
Ha a fentiek nem alakíthatók ki, akkor szintetikus (PTFE) AV-graft, vagy v. basilica transzpozícióval (előemeléssel) kialakított natív fisztula használata javasolt.
Bizonyítottság: A
Tartós vénakatéterek használata csak egyéb lehetőség hiányában javasolt.
Bizonyítottság: C
Amennyiben vénakatéter mellett döntünk, azt csak akkor szükséges behelyezni, amikor a dialízist indítjuk.
Bizonyítottság: A
A tunnelizált vénakatéterek optimális helyzete a jobb v. jugularis interna. Technikai akadály esetén bármely egyéb nagyvéna is használható.
Bizonyítottság: A
A későbbi műtétek esélyének növelése érdekében a progresszív vesebetegség felismerésétől az alkari vénák punkciójának kerülése javasolt.
Bizonyítottság: C
Regionális „vérnyerési központok” kialakítása és folyamatos üzemeltetése jelentősen javíthatna a jelenlegi eredményeken. Megfelelő jártasságú érsebész és kanülálásban jártas nefrológus együttműködésétől várhatóak a legjobb hosszú távú eredmények. Emiatt célszerűnek tűnne ilyen központok létrehozása és finanszírozása.
C szint a javaslat
A DIALIZÁLT BETEGEK ADEKVÁT TÁPLÁLTSÁGA ÉS DIÉTÁS KEZELÉSÜK
Az irányelv célja, alkalmazásának háttere
A dializált betegek jelentős része (különböző vizsgálatok szerint 40-60%-a) mérsékelten-súlyosan alultáplált. Az alultápláltság kialakulása már a predialízis szakban elkezdődik, döntően a KVE-hez társuló acidózis, továbbá a fehérje-anyagcsere, valamint az energiabevitel és -hasznosítás zavara miatt.
Létrejöttében szerepelnek egyes, a tápláltságot, táplálkozást-felszívódást érintő kísérő betegségek, állapotok (foghiány, diabétesz, GI-kórképek, májbetegség, alkoholizmus), valamint szociális tényezők (anyagiak, egyedüllét, a beszerzés akadályai) is. A dialízis, bár az étvágyat és az anyagcsere egyes elemeit javítja, maga is súlyosbítja az alultápláltságot a kezeléssel történő aminosav-, fehérje- és vitaminvesztés, valamint a dializálórendszer bioinkompatibilitása okozta gyulladásos aktiváció révén.
A fehérje-kalória alultápláltság (FKA) fokozza a dializált betegek halálozási kockázatát, szövődményeik (fertőzések, atherosclerosis, balkamra-hipertrófia) gyakoriságát, hospitalizációigényét. Növekszik az EPO igény, a Htk/Hgb célérték nem érhető el, a betegek rehabilitációs esélyei kedvezőtlenek.
A diétás kezelés a krónikus veseelégtelenség komplex ellátásának a dialízissel, gyógyszeres kezeléssel és az életmód-tanácsadással egyenrangú tényezője. A krónikus hemodialízis- és a peritonealis dialízisprogramban kezelt betegek diétájának kompenzálnia kell a kezelések okozta fehérje- és aminosavveszteséget is. A többtényezős alultápláltság megelőzése-kezelése az eltérő okoknak megfelelő beavatkozást, cselekvési tervet igényel.
Az irányelv célja a vesepótló kezelésben részesülő beteg anyagcsere-egyensúlyának megteremtése és fenntartása a kínálat oldaláról, a jól táplált állapot elérése, ennek érdekében a diéta kontrollja, diétás edukáció. A diétás kezelés első lépése a tápláltsági állapot felmérése.
A tápláltsági állapot felmérése
A dialízisre kerülő betegnél első lépés a tápláltsági állapot felmérése. Nincs olyan vizsgálómódszer, mellyel a tápláltsági állapot önmagában leírható lenne, ezért a tápláltságot már bevált módszerek kombinációjával kell jellemezni. A javasolt módszerek: a testméretek vizsgálata (antropometriai mutatók), szérumalbumin koncentrációja, szubjektív tápláltsági felmérés (SZTF), a táplálkozás ellenőrzése interjúval kiegészített háromnapos diétás naplóval, valamint a PNA-érték rendszeres mérése.
Antropometria
Az antropometria a testtömeget számszerűsíti, egyes elemei (felkarkörfogat, bőrredővastagság) a testtömeg egyes elemeinek (izomtömeg, zsír) adnak szemikvantitatív információt. Általánosan használt antropometriai mutatók a testsúly és a testtömegindex: BMI = testtömeg [kg] / (testmagasság [m])2. A testmagasság az életkorral változik, ezért krónikusan dializált betegeknél évente újra meg kell mérni. A sorozatos antropometriai mérések egy személy tápláltsági állapotváltozásának hosszmetszeti értékelésére használhatók. A dializált betegek optimális testsúly-testmagasság viszonya, BMI-célértéke nem ismert. A táplálékfelvétel előírásához a normalizált testtömeget kell használni, erre egyszerű és jól használható a Broca szerinti normalizálás (normalizált testtömeg = a cm-ben mért testmagasság 100 feletti része, kg-ban kifejezve).
Más antropometriai mutatók rutinszerű használata nem követelhető meg, mivel mérésük nagy pontosságot, kellő gyakorlatot igényel, ennek hiányában nagy szórást mutató, téves eredmények születhetnek. A mutatók összehasonlító értékelése kellően validált (kor, nem, fajta szerinti) kontrollcsoportok hiányában ma még nem lehetséges.
A dializált betegek aktuális testsúlya a hidráltsági állapot függvényében széles határok (2-6 kg) között változhat. A megítélés bizonytalanságainak elkerülésére javasolják az ún. korrigált testsúly számítását:
Korrigált testsúly = ödémamentes súly + [(Broca-súly - ödémamentes súly) x 0,25]
Pl. 170 cm magas, ödémamentesen 90 kg-os beteg Broca-súlya 70 kg, korrigált testsúlya ennek alapján 90 + [(70-90) x 0,25] = 87,5 kg.
Megjegyzés: A dializált betegek testsúlya és a BMI a tápláltsági állapot jellemzésére önmagukban nem alkalmasak. A tápláltság megítélésében ezek csak kiegészítő értékek.
Indoklás: Krónikusan dializált betegeknél a BMI számításához használt alapértékek közül a testsúly értékelése bizonytalan (hidráltság, mérési hiba), a testmagasság az urémiás csontbetegség és a gerinc hosszát érintő más eredetű (mozgásszervi) betegségek miatt nem megbízható, mérési hibáját a képlet négyzetesen nagyítja. Obes betegek alultápláltsága a BMI-ben nem jelenik meg.
Szérumalbuminszint
Nemzetközileg elfogadott, egyszerű vizsgálat (a brómkrezol-zöld módszer mindenütt hozzáférhető), értékelését dializált betegeknél a hét közepén dialízis előtt vett vérmintából végzik (átlagos mértékű hiperhidráció valószínű). A szérumalbuminszint a dializált betegek mortalitásának indikátora.
Értékelés: Mérsékelt alultápláltság 35 g/l-től, súlyos alultápláltság 30 g/l alatt. A szérumalbumin az antropometriai módszereknél kevésbé szenzitív, egyidejű gyulladásos aktivitás esetén pedig nem kellően specifikus.
Célérték: A szérumalbumin kívánatos (recommended) értéke legalább 40 g/l.
Indoklás, szakmai háttér: A szérumalbuminszint-mérések alapján a dializált betegek 15-20%-a súlyosan alultáplált, további 25-30% szérumalbumin-értékei a mérsékelten alultáplált tartományba esnek. Számos dializált beteg antropometriai mutatói (BMI, izom- és zsírtömegvesztés) kórosak a már normálisnak tekintett 36-38 g/l szérumalbumin kategóriájában is, a 30-35 g/l-es szérumalbuminsávban pedig gyakran a mérsékeltnél súlyosabb izom- és zsírszövetvesztést tükröznek.
A szérumalbumin célértékét ezért a rendszerint normál antropometriai mutatókkal társuló 40 g/l értékben kell megjelölni. A 35 g/l érték a dietétikai beavatkozást igénylő alsó határ. Dietétikai beavatkozásra azonban a nagyobb érzékenységű antropometriai mutatók és a táplálkozási anamnézis párhuzamos értékelése alapján már a 35-39 g/l közötti „szürke zónában” is szükség lehet.
A szérumalbumin alacsony lehet elsődlegesen nem táplálkozási okok miatt is. Az elmúlt években számos közlemény utalt rá, hogy a szérumalbumin negatív akutfázisprotein-szintje a különböző (bakteriális, nem bakteriális eredetű) gyulladásos állapotok (ingerek, fokozott cytokintermelés) hatására csökken. A fokozott cytokintermeléssel járó állapotok a napi gyakorlatban a CRP-szinttel jellemezhetők.
A szérumalbumint mint tápláltsági markert csak a CRP egyidejű mérésével szabad értékelni. Emelkedett CRP nem zárja ki az alacsony szérumalbumin táplálkozási eredetét - a krónikus gyulladások, senyvesztő folyamatok gyakran társulnak negatív N-egyensúllyal, étvágytalansággal. Utóbbi esetben a szérumalbumin tartós korrekciója a dietétikai beavatkozás mellett csak a kiváltó állapot (pl. krónikus bronchitis, colitis, immunpatológiai kórképek) egyidejű hatásos kezelésével érhető el.
Szubjektív tápláltsági felmérés (SZTF)
A dializált betegek tápláltsági állapotának jellemzésére nemzetközileg elfogadott egyszerű, reprodukálható módszer. Lényege a súlyosan (C) és mérsékelten (B) alultáplált betegek klinikai jellemzése és elkülönítése a megfelelően tápláltaktól (A), többtényezős (anamnézis, fizikai vizsgálat) értékelés alapján. Az állapotváltozás pontosabb követése érdekében a felmérés pontozással (hétpontos vagy a hazai 24 pontos skála) egészíthető ki, a mindennapos gyakorlatban az egyszerű hármas csoportosítás (A, B, C) is bevált.
Értékelés: A módszer részletes leírása szerint történik, a jóltápláltság jelölése A, a mérsékelten-közepesen alultáplált állapot B, a súlyos alultápláltság jelölése C. A hazai gyakorlatban használt 24 pontos skálán a jó tápláltsági állapot 4-5 pont, enyhe alultápláltság 6-11, mérsékelt 12-17, súlyos 18-24 pont. Dietétikai vagy gyógyszeres beavatkozások hatása a módszerrel megbízhatóan fél év után értékelhető, egyes jellemzők (táplálkozási anamnézis, súlyváltozás, erőnlét) a változás irányáról már három hónap után tájékoztatnak.
Célérték: A jól táplált állapot jellemzőinek elérése, ennek hiányában a SZTF jellemzőinek (pontszám) következetesen javuló tendenciája.
Szakmai háttér: Az SZTF magában foglalja a testsúlyváltozás, a táplálkozási jellemzők, az erőnlét anamnesztikus értékelését, valamint a zsír- és izomtömeg standard szempontok szerinti (szubjektív) becslését a test meghatározott területein. Összetett jellegéből eredően a tápláltságot a testsúly-testmagasság aktuális viszonyától függetlenül jellemzi.
A módszert dializált betegek tápláltságának értékelésére tömegméretekben először a CANUSA vizsgálatban alkalmazták, a tápláltságot és a kapcsolódó halálozási kockázatot jellemző prediktív értéke a szérumalbuminnál jobbnak bizonyult. Hazai rendszeres alkalmazása 1995-re vezethető vissza, a Ketosteril-pótlás követéses vizsgálatában a 24 pontos skála jól használhatónak bizonyult. Megbízható alkalmazásának feltétele, hogy a beteg felmérését a különböző időpontokban kellő gyakorlatot szerzett, azonos személy (orvos, dietetikus vagy nefrológiai szakápoló) végezze.
„Fehérjekatabolikus ráta” (nPCR)
Elsődlegesen nem tápláltsági mutató, a fehérjebontás mértékéről tájékoztat, táplálkozási, ill. anyagcsere-tendenciát jelez. A karbamid formájában megjelenő napi fehérjebontást jelzi, értéke semleges nitrogénegyensúly esetén a napi fehérjebevitellel (DPI) azonos. Dializált betegek nPCR-értéke a kezelés hatásfokát a táplálkozás oldaláról jellemzi.
Célérték: Hemodializált betegeknél 1,2 g/normalizált ttkg/nap, peritonealisan dializált betegeknél 1,4 g/ttkg/nap.
Indoklás, értelmezés: A belekből felszívódott fehérjékből/aminosavakból a májban képződött karbamid döntő hányada a test víztereiben változatlan formában oszlik meg, a vizelettel ürül vagy a dialízissel távolítjuk el. A vizeletből egyszerűen mérhető (ez az ún. UNA - Urinary Nitrogen Appearance [g/nap]), az érték a táplálékkal bevitt fehérje mennyiségével jól egybevág, de a bevitel jellemzésére csak semleges nitrogénegyensúly esetén alkalmas. Hasonló következtetések levonására alkalmas a dializált betegek kezelés utáni és előtti se. KN értékéből számított PCR is, melynek normalizált testsúlyra (Broca) vonatkoztatott értéke az nPCR.
Dializált betegek nPCR-értékének jelentősége: a dialízis hatásfokát jelző Kt/V értéke csak az nPCR egyidejű normál értéke mellett tekinthető megfelelőnek. Önmagában az nPCR normál értéke nem jelent kielégítő táplálkozást: csak a diétás naplóból megbízhatóan számított energiabevitellel együtt értékelhető (elégtelen energiabevitel = katabolizmus).
A napi energiabevitel mérése, diétás napló
A napi energiabevitel a veseelégtelen betegek tápláltságának és (egyben) együttműködésének fontos jellemzője, a fehérjék-aminosavak hasznosulásának alapja.
Értékelés: Az energiabevitel értékelésének nemzetközileg elfogadott módszere az interjúval kiegészített háromnapos diétás napló. Más - objektívebb - klinikai módszer a tényleges energiabevitel gyakorlati mérésére nem ismeretes.
Célérték: Dializált betegeknél 30-35 kcal/ttkg/nap. Interkurrens betegségek az energiaigényt növelik.
Indoklás, értelmezés: A 35 kcal/ttkg/nap az átlagos aktivitású normál egyén napi bevitele. A dializált betegek nyugalmi energiaigénye (REE - Resting Energy Expenditure) fokozott, ezt a bevitellel kompenzálni kell. Az energiabevitel növelésével párhuzamosan javul (egyre pozitívabbá válik) a N-egyensúly, nem elhízott egyéneknél ezért a „minél több, annál jobb” elve érvényesíthető. Bár a dializált betegek fizikai aktivitása átlag alatti, s életkor szerint közülük sokan naponta kevesebb (50 év felett 30 kcal/ttkg/nap) energiát igényelnének, a krónikus veseelégtelenség és a dialízis anyagcserét módosító tényezői miatt az aktív, nem idős felnőttek energiabevitelét írják elő számukra. BMI szerint elhízottnak minősülő betegek előírt energiabevitele a korrekció időszakában ennél alacsonyabb lehet.
Az alultápláltság kezelése dializált betegeknél
A szociális tényezők korrekciója
Ezeket kell elsőként megvizsgálni az alultápláltság korrekciójához. Alapkérdés: képes-e az alultáplált beteg az előírt minőségű és mennyiségű hagyományos tápanyagot beszerezni (anyagi helyzet, mozgásképesség, mentális funkciók) és ételeit el-, ill. előkészíteni? Ehhez a dietetikus és a szociális munkás (vagy a funkcióját ellátó személy) együttműködése szükséges. Szükséges információk: beszerzés lehetősége, anyagiak, elkészítéssegítő személy, otthoni támogatás mértéke.
Dietétikai felmérés és edukáció
Minden dializált betegnél elvégzendő a programba vétel során, majd a dialízis folyamán rendszeresen.
Táplálkozási anamnézis felvétele, mely kitér a rágás, nyelés, emésztés képességére, kapcsolódó panaszokra, egyes ételfajtákkal kapcsolatos averzióra (az „étvágytalanság” gyakran csak egyes ételek elutasítását takarja), a testsúly változására (túlsúlyos betegek alultápláltsága!), egyes GI-tünetekre (hányás, hasmenés, puffadás). Célszerűen a szubjektív tápláltsági felmérés részeként történik. Kontrollja negyedévente, ill. állapotváltozás esetén szükséges.
Szubjektív tápláltsági felmérés, majd ennek ismétlése legalább félévente. Kiegészíti a testsúly meghatározása.
A biokémiai értékek (szérumalbumin, nPCR) mérése és számítása, majd ezek ismétlése havonta (szérumalbumin), ill. negyedévente (nPCR).
Háromnapos diétás napló elemzése interjúval (a továbbiakban diétás napló) - kezdetben elvégzendő, majd az edukáció hatásfokának mérésére később ismétlendő felmérés. Elérendő a dializált betegek számára előírt napi fehérje (1,2 g/normalizált ttkg - HD, 1,4 g - CAPD) és energiabevitel (35 kcal/normalizált ttkg/nap, el nem hízott betegeknél). A fehérjebevitel az nPCR-értékkel ellenőrizhető, az energiabevitel csak a diétás naplóval.
Edukáció: folyamat, indokolt minden dializált betegnél. Mérsékelten alultáplált betegeknél első lépcsőben a hagyományos táplálékokkal történő korrekciót szolgálja, kéthetente legalább félórás egyéni foglalkozással, három hónapos periódusban. A későbbiekben ennek alapján dönthető el a további lépések igénye. Hiányában a táplálkozási állapot változtatását célzó mindennapos módszerek hatástalanok.
Per os mesterséges táplálás
Indokolt, ha a „Dietétikai felmérés és edukáció” fejezetben részletezett, kellő intenzitású edukáció után, hagyományos táplálékok fogyasztásával a mérsékelt alultápláltság jelei nem változnak, a szükséges fehérjebevitel (nPCR) nem érhető el, vagy ha kezdettől súlyos fehérje-kalória alultápláltság (szérumalbumin, diétás napló, antropometria) észlelhető. A különböző beavatkozások hatásáról általában kisszámú betegcsoportokon végzett megfigyelésekben számolnak be, prospektív, randomizált, multicentrikus vizsgálat nincs.
Lehetőségei:
- Hagyományos per os mesterséges tápszerek - döntően a kalorikus alultápláltság korrekciójára alkalmasak, hátrányuk a foszfor- és fehérje- (nitrogén-) terhelés. Kedvező hatásukról számoltak be.
- EAS/ketosavkeverék, Ketosteril - döntően az elégtelen fehérje-, ill. EAS-bevitel korrekciójára. Normalizált ttkg-ra számítva 1 tbl/5 ttkg, fokozatos emeléssel egy hónap alatt az előírt mennyiségre, az energiabevitel egyidejű korrekciója mellett. Az EAS/KS pótlás hatása dializált betegek tápláltságára követéses és kontrollált vizsgálatokban bizonyított.
A hatás méréséhez legalább három hónapos, kellően ellenőrzött kezelési periódusra van szükség. Dietétikai ellenőrzés (havonta diétás napló, nPCR mérés, szérumalbumin, BMI) mellett elhagyható a per os mesterséges táplálás, ha a tápláltsági célértéket a beteg elérte.
Parenteralis táplálás
Indokolt, ha a kellő intenzitással (Kt/V célérték elérve) dializált betegnél dietetikussal együttműködve a felsorolt per os módszerek egyikével sem sikerült a tápláltsági (szérumalbumin, BMI, SZTF) és együttműködési (nPCR, energia) célértékeket elérni. A módszer célja a per os stabilizálható tápláltság elérése. A parenteralis pótlás feltételezi a per os kellő táplálkozás kialakítására tett megelőző, ill. egyidejű hatásos lépéseket (edukáció, diéta elemzése, per os pótlás folytatása).
IDPN - a parenteralis táplálás speciális formája: intradialitikus parenteralis táplálás. A hagyományosan táplálkozó, más módon nem javíthatóan alultáplált dializált beteg heti háromszori vagy többszöri hemodialízis során infúzióban 2-300 g glükózt, 100-200 ml 20% lipidemulziót és általában 200 ml EAS-keveréket (Nephrotect) kap. Az IDPN viszonylag magas költségéhez mérsékelt hatás társul, amint azt a viszonylag kisszámú kohorsz mutatja.
Nutrineal - peritonealisan dializált betegek számára egy éjszakai cserében adható, EAS-tartalmú oldat, indoka és célja az intradialitikus parenteralis táplálással egyező (költséges módszer, másként nem szupplementálható CAPD betegeknél alkalmazzák, a tápláltság változásáról a közlemények eltérő adatokat közölnek).
Teljes parenteralis táplálás (TPN) - hazai viszonyok között a krónikusan dializált járó betegek alultápláltságának javítására nem használatos. Átmenetileg, intézeti körülmények között, súlyos anyagcsere-kisiklások után, posztagressziós állapotban lehet indokolt.
A DIALIZÁLT BETEGEK
GYÓGYSZERES KEZELÉSE
A kalcium-foszfor anyagcsere komplex kezelése
A kalcium-, foszfor- és csontanyagcsere, valamint a mellékpajzsmirigy működésének zavarai enyhébb-súlyosabb formában minden, krónikus veseelégtelenségben szenvedő betegnél kialakulnak, legsúlyosabb formájukban a vesepótló kezelésben részesülők körében nyilvánulnak meg. Ma Magyarországon a vesepótló kezelésben részesülők száma (dialíziskezelés vagy működő transzplantált vese) több mint ötezer, ugyanakkor százezernél is több ember él különböző súlyosságú krónikus veseelégtelenséggel, s e betegeknél mindenképpen figyelmet érdemel a kalcium- (Ca), foszfor- (P) és csontanyagcsere, a parathormonszint (iPTH) monitorozása, és számos esetben már jóval a dialízis megkezdésének szükségessége előtt e téren terápiás intervencióra is szükség lehet.
A renalis osteodystrophia a krónikus vesebetegség bármely stádiumában kialakulhat. Különböző típusait (osteomalacia, adinámiás csontbetegség, enyhe osteitis fibrosa, kevert osteodystrophia, osteitis fibrosa) a csontátépülés mértéke alapján különítjük el, így ezek pontos diagnózisa csak szövettani vizsgálat során lehetséges.
E problémakör több ok miatt is figyelmet érdemel. Az előrehaladott veseelégtelenség egyik legtöbb szenvedést okozó következménye a renalis osteodystrophia (ROD), amely súlyos panaszokat okozhat, s nagymértékben rontja a betegek életminőségét. Fontos szempont az is, hogy a fenti anyagcsere-eltérések az idejekorán megkezdett diétás és megfelelően alkalmazott gyógyszeres kezeléssel a vesebetegség minden stádiumában nagyrészt kontrollálhatók. Ennek sikere azon múlik, hogy a kezelés kellő időben elkezdődjék, a beteg élete végéig folytatódjék, és az osteodystrophia típusának megfelelő legyen. A krónikus vesebetegségben szenvedők nagy része több kockázati tényezővel rendelkezik az osteoporosis kialakulása szempontjából is, s adatok utalnak arra, hogy a csonttörések gyakorisága e populációban lényegesen meghaladja az átlagpopuláció értékeit. Ennek pedig igencsak nagy hatása van a betegek életkilátásaira és életminőségére, de ellátásuk költségeire is.
A problémakör jelentőségét alátámasztják azok az adatok, amelyek szerint a szérumfoszforszint, illetve a CaxP szorzat a dializált betegek mortalitásának független prediktora (Block, AJKD). Különösen fontosak lehetnek a napi gyakorlat szempontjából azok az adatok, melyek a CaxP szorzat szerepét vetik fel a dializált betegeknél igen súlyos formában jelentkező, gyorsan progrediáló vascularis kalcifikáció kialakulásában és progressziójában (Salusky, Slatopolsky), mely fontos szerepet játszhat a krónikus vesebetegek nagymértékben emelkedett cardiovascularis mortalitásának patogenezisében.
Hasonló fontosságú a Ca-, P-anyagcsere és a mellékpajzsmirigy-működés közötti kapcsolat is. A veseműködés beszűkülésének adott szintjén nagy valószínűséggel kialakul a mellékpajzsmirigy funkciózavara is: ez lehet túlműködés, szekunder hyperparathyreosis vagy relatív hipofunkció is. A szekunder hyperparathyreosis a Ca-, P- anyagcsere befolyásolása mellett alapvető szerepet játszik a gyors turnoverű csontbetegség patogenezisében, s ezen túlmenően befolyásolja a betegek vérképzését (EPO rezisztencia), cardiovascularis állapotukat (myocardialis fibrosis, vascularis kalcifikáció stb.). A mellékpajzsmirigy relatív hipofunkciója, mely az utóbbi években egyre gyakrabban észlelhető, elsősorban az idős, diabéteszes betegek, valamint a peritonealis dialízissel kezeltek körében az adinámiás csontbetegség (ABD) központi patogenetikai elme, s részben azon keresztül szintén hozzájárulhat a cardiovascularis és egyéb extraosszeális kalcifikáció, valamint a kalcifilaxis kialakulásához.
A kalcium-, foszfor- és csontanyagcsere kezelését és diagnosztikáját szolgáló irányelvek frissítését, újragondolását több szempont is indokolja. Az elmúlt években olyan új ismeretek láttak napvilágot, melyek befolyásolják e problémakör ellátásának napi gyakorlatát, s az irányelvek elősegíthetik ezen ismeretek elterjedését, alkalmazását. Másrészről rendelkezünk arra vonatkozó - bár töredékes - adatokkal is, hogy egyéb részterületekhez hasonlóan a Ca-, P-, mellékpajzsmirigy- és csontanyagcsere-zavarok ellátásában is jelentős variációkkal találkozhatunk. E variációk elsősorban a dializált betegek szérumfoszforszintjének csökkentése, a foszfátkötők alkalmazása, a D-vitamin-készítmények alkalmazása terén figyelhetők meg, de érvényesülnek pl. a parathyreoidectomia indikációjánál is.
E variációk egy részét mindenképpen indokolatlannak kell tartanunk, s bizonyos, hogy azok rontják az ellátás minőségét, hátrányosan befolyásolják a betegek állapotát. Az irányelvek megfogalmazása, az ajánlások követésének előmozdítása, valamint azok folyamatos ellenőrzése (pl. klinikai audit formájában) elősegítheti e variációk mértékének csökkenését s ezáltal a betegellátás színvonalának javítását.
A kalcium-, foszfor- és csontanyagcsere monitorozása
Összefoglalás
Krónikus veseelégtelenségben szenvedő betegeknél a vesefunkció ellenőrzésével egy időben a szérumkalcium, -foszfát és a HCO3 szintjének ellenőrzése is szükséges.
Krónikus veseelégtelen betegeknél 30 ml/min GFR felett hathavonta, ennél súlyosabb veseelégtelenség fennállása esetén 3 havonta javasolt az iPTH ellenőrzése.
E betegpopulációban a mért paramétereket a kezeléssel a normál tartományon belül kell tartani. 30 ml/min GFR alatt az iPTH értékét a normál tartomány 1-3-szorosa között kell beállítani.
Tartósan dializált betegeknél a szérumkalcium, -foszfát és a HCO3 szintjének rendszeres, legalább havonkénti ellenőrzése szükséges. A mérés a dialízis előtt közvetlenül levett vérből történjék. A kezelés - dialízis és gyógyszeres - célja, hogy e paraméterek értéke az alábbi céltartományokon belül legyen:
- Ca: 2,25-2,6 mmol/l
- P: 0,8-1,8 mmol/l
- CaxP szorzat: <4,7
- HCO3: 20-24 mmol/l
Amennyiben a korábban céltartományon belül lévő szérumfoszfor emelkedik vagy tartósan magas, a következő lépések szükségesek:
- a dialízisdózis s egyes komponenseinek (kezelési idő, filter mérete, vérpumpa sebessége) felülvizsgálata a beteg étrendjének áttekintése, foszforszegény étrendre vonatkozó diétás tanácsadás;
- foszfátkötők adagjának revideálása aktív D-vitamin-kezelés felfüggesztése (1,9 mmol/l se. P felett).
Hypercalcaemia észlelése esetén a következő teendők szükségesek:
- kalciumtartalmú foszfátkötők adagjának csökkentése;
- dializátum Ca-koncentrációjának csökkentése;
- D-vitamin-származék adásának felfüggesztése.
A szérumkalcium kívánatos értékének elérése érdekében a dializátum Ca-koncentrációját 1,25-1,75 mmol/l között változtassuk. A legtöbb beteg esetében az 1,5 mmol/l vagy ennél alacsonyabb Ca-koncentrációjú dializátum javasolt. 1,75 mmol/l koncentrációjú dializátum azoknál a betegeknél fogadható el, akiknek se. Ca-koncentrációja tartósan 2,3 mmol/l alatt van, a megfelelő terápiás próbálkozások ellenére. Egyes esetekbe szükséges lehet a dializátum Ca-koncentrációjának 1,0 mmol/l-re történő csökkentése, amennyiben tartósan hypercalcaemia és hyperphosphataemia áll fenn.
A mellékpajzsmirigy-működés és a csontanyagcsere monitorozása céljából a szérum intakt parathormonjának (iPTH) legalább háromhavonkénti meghatározása szükséges. Intenzív aktív D-vitamin-kezelés vagy alacsony (1,0 mmol/l) kalciumkoncentrációjú dializátummal való kezelés esetén havonkénti iPTH-ellenőrzés szükséges.
Az iPTH céltartománya dializált betegek esetében a normál tartomány 3-5-szöröse.
Az iPTH-mérés mellett további információt adhat a csontanyagcsere szérummarkereinek (csontspecifikus alkalikus foszfatáz, a szérum piridinolin-keresztkötései) ellenőrzése.
Tartósan dializált betegek esetében szükséges a szérumalumínium 6 havonkénti ellenőrzése. 20 mikrogramm/l feletti érték esetén további teendők szükségesek (DFO-teszt).
Dializált betegeknél javasolt a szérum 25(OH) D-vitamin-szint félévenkénti ellenőrzése a hipovitaminózis felismerése érdekében. Céltartomány: 30-60 ng/ml.
Bizonyos esetben a csontbetegség pontos diagnózisa érdekében csontbiopszia végzendő:
- parathyreoidectomia előtt, ha a beteg alumíniumtartalmú foszfátkötőt is szedett, vagy a szérumalumínium magas volt csontfájdalom esetén, ha az iPTH a normál tartomány 1-4-szerese.
- adinámiás és alumínium okozta csontbetegség elkülönítésére, ha erre gyanú támad.
A csonttörési kockázat megállapítása érdekében a dializált betegeknél egy-két évenként oszteodenzitometriás vizsgálat javasolt.
Részletes rész
A krónikus veseelégtelenség progressziója során számos olyan metabolikus eltérés alakul ki, melyek a szérumkalcium, -foszfor szintjének eltéréseire, metabolikus acidózisra, a mellékpajzsmirigy enyhébb-súlyosabb funkciózavarára s részben ezek következtében renalis osteodystrophia kialakulására vezetnek. A tubularis funkciók károsodása következtében hyperphosphataemia, részben következményesen hypocalcaemia alakul ki. Csökken a vese kalcitrioltermelő képessége, a kalcium, foszfor anyagcserezavara, a kalcitriol hiánya következtében szekunder hyperparathyreosis alakul ki.
Ezek az eltérések lényegében minden, krónikus veseelégtelenségben szenvedő betegnél kialakulnak, s az életminőséget s meghatározott mechanizmusok révén az életkilátásokat is hátrányosan befolyásolják. Ezért igen fontos, hogy az eltéréseket idejekorán észleljük, s megfelelő, komplex kezeléssel megelőzzük a súlyosabb következmények kialakulását. Ennek eléréséhez, valamint a terápiás intervenciók hatásának monitorozásához, az esetleges nem kívánt hatások minél korábban történő észleléséhez szükséges a szérumkalcium, -foszfor, a sav-bázis anyagcsere rendszeres ellenőrzése.
Az utóbbi években közölt adatok alapján mindenképpen törekedni kell arra, hogy a Ca és P értékét a normál tartományon belül tartsuk. A Ca esetében ez a Ca-tartalmú foszfátkötők alkalmazása és a dializátum Ca-koncentrációjának változtatása, valamint a D-vitamin-származékok megfelelő indikálása révén érhető el. Az adinámiás csontbetegség egyre gyakoribb előfordulása, valamint a Ca-tartalmú gyógyszerek alkalmazása következtében a hypercalcaemia nem ritka szövődmény. Különösen komoly kockázatot jelent akkor, ha hyperphosphataemiával szövődik, mert ilyenkor nagyon megnő a lágyrész-meszesedések, ezen belül a legfontosabb cardiovascularis kalcifikáció kockázata. Emiatt különös figyelmet érdemel a hypercalcaemia megelőzése a dializátum Ca-koncentrációjának megfelelő beállításával és szükség esetén kalciumot nem tartalmazó foszfátkötő (sevelamer HCl-, Mg- vagy alumíniumtartalmú gyógyszerek) alkalmazásával.
A hyperphosphataemia kezeléséről később szólunk. A dializátum Ca-koncentrációját illetően az 1,5 mmol/l javasolható, mert ennek alkalmazása esetén nincs nettó Ca-transzport a beteg és a dializátum között. Amennyiben nagyobb adagban alkalmazunk Ca-tartalmú gyógyszereket, szükség lehet a dializátum Ca-koncentrációjának csökkentésére (1,25 mmol/l vagy ritkán 1,0 mmol/l). Hasonlóképpen szükség lehet alacsony Ca-tartalmú dializátum alkalmazására peritonealis dialízissel kezelt beteg esetében. A dializátum Ca-koncentrációjának csökkentésekor az iPTH szoros monitorozása szükséges, hiszen az alacsony Ca-koncentráció mellett az iPTH-szint emelkedhet. Ez azonban ritkán olyan mértékű, ami kontraindikálná az oldat módosítását.
A predialízis stádiumában is szükséges a beteg sav-bázis állapotának felmérése, s amennyiben komolyabb metabolikus acidózis áll fenn, annak NaHCO3 vagy CaCO3 adásával történő korrigálása szükséges. Kerülendő a citráttartalmú gyógyszerek adása e betegpopulációban, hiszen az alumínium felszívódását elősegíthetik.
A fenti paraméterek rendszeres monitorozása ellenére is igen gyakran fellép a mellékpajzsmirigy funkciózavara, mely igen sokáig tünetmentes lehet. A korábban ismertetett tényezők együttes hatására a betegek egy részénél szekunder (renalis) hyperparathyreosis alakul ki, mely tartós fennállás után gyors turnoverű csontbetegségre, osteitis fibrosa kialakulására vezet. A betegek más csoportjában, elsősorban idős, diabéteszes betegeknél relatív vagy abszolút hypoparathyreosis alakul ki. Ezen állapotok felismerése és elkülönítése csak a mellékpajzsmirigy-funkció rendszeres monitorozása révén érhető el.
A jelenleg rendelkezésre álló adatok alapján az intakt parathormon meghatározása adja a legmegbízhatóbb, klinikai szempontból használható eredményt a mellékpajzsmirigy funkciójáról s a csontanyagcsere állapotáról is. Az utóbbi években ismertté vált ugyanakkor, hogy az iPTH mérésekor inaktív vagy egyenesen gátló hatású peptidfragmenteket is meghatároznak - részben ez lehet az oka, hogy a veseelégtelen betegek körében az iPTH normál tartományát lényegesen meghaladó mennyiségű hormon szükséges a normálhoz leginkább közel álló csontanyagcsere fenntartásához (Qi et al, Wang et al). Dializált betegek esetében a normál tartomány 3-5-szöröse, ugyanis ezen értékek mellett a legnagyobb a normál csontanyagcsere fennállásának valószínűsége. Nem ismert azonban, hogy a predialízis szakban milyen iPTH-értékek elérése a legcélszerűbb, ezért e betegpopulációban korai stádiumban (GFR>30 ml/min) az iPTH-t a normál tartományon belül célszerű tartani, előrehaladottabb veseelégtelenség esetén is valószínűleg célszerű a normál tartomány 2-szeres értéke alatt maradni. Az utóbbi években megjelent egy új, a teljes PTH-molekulát mérő assay, ennek klinikai előnye azonban nem bizonyított.
A hyperparathyreosis számos hátrányos következménye közül az egyik leggyakoribb s a beteg életminőségét leginkább meghatározó állapot a renalis osteodystrophia. A renalis osteodystrophia patogenezisében a mellékpajzsmirigy funkciózavara mellett alapvető jelentőségű az urémiás környezet hatása a csontanyagcserére, s azt számos egyéb tényező is befolyásolja. Mindezen eltérések kialakulásához, progressziójához hozzájárul a nemi hormonok csökkent termelődése, valamint a kalciumérzékelő receptor (CaSR) funkciózavara is. Elsősorban ennek a komplex patogenezisnek tudható be, hogy a csontanyagcsere és az iPTH közötti kapcsolat nem teljesen szoros, ezért a csontanyagcsere követésére az iPTH mellett egyéb eszközök is szükségesek.
A renalis osteodystrophia egyes formáinak elkülönítéséhez a referenciát a kettős tetraciklines jelölést követő transiliacalis csontbiopszia standardizált hisztomorfometriás elemzése jelenti. A csontátépülési ráta (bone formation rate) alapján gyors és lassú átépüléssel járó ROD-formákat különíthetünk el. A gyors átépüléssel járó formák közé tartozik az osteitis fibrosa, kialakulásában döntő szerepet játszik a szekunder hyperparathyreosis. A lassú átépüléssel járó elváltozások közé az osteomalacia és a közelmúltban leírt adinámiás csontelváltozás (adynamic bone disease - adinámiás csontbetegség) tartozik. A két csoport elkülönítése - az eltérő prognózis, valamint a teljesen eltérő terápiás következmények miatt - mindenképpen szükséges volna. Erre azonban az iPTH csak részben alkalmas, mivel egy jelentős tartományában értéke nem mutat kapcsolatot a csont szövettani képével.
E tartományban lehet jelentősége a csontanyagcsere, azaz a csontépítés és a csontlebontás szérummarkereinek. E markerek klinikai jelentőségét több tanulmány vizsgálta, hasznosságukat korlátozottnak találta. Abban azonban több tanulmány is egyetértett, hogy az adinámiás csontbetegség diagnózisában a csontspecifikus alkalikus foszfatáz kiegészítheti az iPTH mérésével kapott eredményeket. Ugyancsak segíthet a csontanyagcsere megítélésében a szérum pyridinium-keresztkötéseinek vagy a tartarátrezisztens acid-foszfatáz meghatározása.
A számos elméleti és módszertani nehézség miatt sok esetben a csontbetegség pontos diagnózisa csak kettős tetraciklines előjelölés után végzett transiliacalis csontbiopszia szövettani vizsgálata révén érhető el. Szükség volna e vizsgálatra olyan esetekben is, amikor a csontban esetlegesen lerakódott alumínium mennyiségének meghatározása fontos a terápiás teendők meghatározása érdekében (parathyreoidectomia előtt - a műtét után lassuló csontanyagcsere mellett súlyos alumínium-csontbetegség alakulhat ki; súlyos musculosceletalis tünetek és alacsony iPTH fennállása esetén adinámiás csontbetegség és alumínium-csontbetegség elkülönítésére). Ma Magyarországon költségei, valamint a patológiai háttér hiányában e vizsgálat nem érhető el.
Mivel az alumíniumtartalmú foszfátkötők alkalmazása nem kerülhető el teljes mértékben, s a betegek Al-expozíciója a dializátum felől sem zárható ki teljes mértékben, szükségesnek látszik a szérumalumínium időszakos ellenőrzése, s magas értékek észlelése esetén szükség lehet a desferrioxamin (DFO)-teszt alkalmazására is.
Több epidemiológiai vizsgálat is kimutatta, hogy a dializált betegek D-vitamin-ellátottsága elégtelen, s arra is vannak adatok, hogy ez hozzájárulhat a hyperparathyreosis kialakulásához. Ezért célszerű a betegek D-vitamin-ellátottságának ellenőrzése a szérum 25(OH)D3-szint mérésével, s hipovitaminózis fennállása esetén natív D-vitamin adásával annak korrigálása. Amennyiben natív D-vitamint adunk, mindenképpen kis dózisban (heti 6-9000 E) célszerű azt alkalmazni, hogy a hipervitaminózis s az esetleges hypercalcaemia kialakulását elkerüljük.
Epidemiológiai adatok alapján a dializált betegeknél csökkent a csontok ásványianyag-tartalma, s az átlagpopulációhoz képest jelentős mértékben fokozott a csonttörés veszélye. Ehhez hozzájárul a mellékpajzsmirigy működészavara: mind hyperparathyreosis, mind relatív hypoparathyreosis esetén csökkent lehet a csontok ásványianyag-tartalma. További tényező a nemi hormonok hiánya s esetlegesen további humorális tényezők szerepe. Jelenleg ugyanakkor nem rendelkezünk olyan adatokkal, amelyek alátámasztanák, hogy az átlagpopulációban használatos hatékony terápiás eszközök (biszfoszfonátok) e populációban biztonságosan adhatók és hatékonyak. Anekdotális adatok alapján feltételezhető, hogy a pamidronát a dózis csökkentése mellett biztonságosan alkalmazható dializált betegeknél, ennek vizsgálatára ugyanakkor szisztematikus klinikai vizsgálatok szükségesek. Így a csonttörés veszélyének csökkentése érdekében egyelőre a szérumkalcium- és -foszforszint normalizálása és a szekunder hyperparathyreosis megelőzése, illetve kezelése az alkalmazandó terápia.
A hyperphosphataemia kezelése
Összefoglalás
Hyperphosphataemia (>1,7 mmol/l) észlelése esetén a dialízisparaméterek áttekintése mellett diétás tanácsadás szükséges. A napi foszfátbevitel javasolt értéke 800-1100 mg (18-36 mmol).
A hyperphosphataemia kezelésére foszfátkötők szükségesek a foszfor bélből való felszívódásának csökkentése érdekében. E célból elsősorban kalciumsók (CaCO3, Ca-acetát) és sevelamer HCl adása javasolt. Szükség esetén átmenetileg magnézium- és alumíniumtartalmú készítmények is adhatók, a szérum Mg és Al szoros monitorozása mellett.
A gyomor savszekrécióját csökkentő gyógyszerek mellett kalcium-acetát adása előnyösebb, mint a CaCO3, ennek adása megfontolandó.
Nagyobb adagú Ca-tartalmú foszfátkötő alkalmazása esetén a dializátum Ca-koncentrációjának csökkentése (1,25 vagy 1,0 mmol/l-re) válhat szükségessé a hypercalcaemia megelőzése érdekében.
Terápiarezisztens hyperphosphataemia esetén a dialíziskezelés intenzifikálásával (gyakoribb - heti 4-5-szöri - és/vagy hosszabb - 5-6 óra - kezelések) a szérumfoszfor normalizálható.
Részletes rész
A hyperphosphataemia a veseelégtelenség egyik korai következménye, s fontos szerepet játszik a szekunder hyperparathyreosis, a ROD, valamint a metasztatikus kalcifikációk kialakulásában. Mindennek révén jelentős szerepe van a dializált betegek morbiditásának, valamint mortalitásának meghatározásában. A hyperphosphataemia a dializált betegek mortalitásának független prediktora. Ezért fontos, hogy a krónikus veseelégtelen betegek kezelése során a szérumfoszforszintet normalizáljuk.
E cél eléréséhez diétás rendszabályok előírása, foszfátkötők alkalmazása, a dialíziskezelés során történő foszfáteltávolítás áll rendelkezésünkre.
A terápiás erőfeszítések sikerét nagymértékben meghatározza a betegek együttműködési készsége (compliance), amit kellő információ biztosításával, gyakori tanácsadással érhetünk el.
A diétás megszorítások szerepe korlátozott, hiszen a kellő fehérjebevitel (1,2 g/ttkg) biztosítása mindenképpen szükséges, s ebben az esetben mindenképpen pozitív foszfátegyensúly (azaz foszfátretenció) alakul ki. A kellő mennyiségű fehérjét tartalmazó étrend ugyanis 800-1200 mg (26-40 mmol) foszfátbevitelt jelent, s a felszívódott mennyiség mindenképpen meghaladja a károsodott vese kiválasztóképességét vagy a hagyományos dialíziskezelés foszfáteltávolító kapacitását.
A hagyományos dózisban (heti 3x4 óra hemodialízis vagy hemodiafiltráció) alkalmazott dialízis során kb. heti 60-120 mmol foszfát eltávolítása lehetséges. Ugyanez az érték CAPD esetén heti 70-85 mmol. Ez azt jelenti, hogy számos dializált betegnél pozitív foszfátegyensúly alakul ki, még optimális diétás együttműködés esetén is. Bár egyes adatok arra utalnak, hogy a hemodiafiltrációval nagyobb mennyiségű foszfát távolítható el, mint konvencionális hemodialízissel, ez a különbség a fenti problémát a betegek legnagyobb részénél nem oldja meg. Több, megfigyelésen alapuló, nem kontrollált vizsgálat adatai arra utalnak, hogy a szokásosnál gyakoribb és/vagy hosszabb dialízis alkalmazásával (heti 3x6-8 óra; heti 4-6x3-8 óra) a szérumfoszfátszint a legtöbb betegnél foszfátkötők alkalmazása nélkül, szabad diéta mellett is biztosítható. E módszer alkalmazása egyelőre financiális és logisztikai okok miatt nem terjedt el széles körben.
Mindezek miatt elengedhetetlen a foszfátkötő készítmények alkalmazása, melyek célja a foszfor bélben való megkötése, a felszívódás megakadályozása. Jelenleg a legelterjedtebben a kalciumtartalmú foszfátkötőket alkalmazzák, ezek közül is leginkább kalcium-karbonátot (CaCO3).
E két vegyület foszfátkötő hatékonysága némiképp eltérő, elemi kalciumra számítva a kalcium-acetát a hatékonyabb. Ugyanakkor a klinikai alkalmazhatóság tekintetében számottevő különbség a két készítmény között nem mutatható ki, a mellékhatások gyakorisága hasonló. A kalcium-acetát alkalmazása előnyös lehet olyan betegeknél, akik gyomorsav-szekréciót gátló készítményeket is szednek (H2-receptor blokkolók, protonpumpagátlók), ugyanis a karbonát csak savas közegben oldódik, míg a kalcium-acetát bármely pH-értéknél oldható.
Az elmúlt években a kalciumtartalmú foszfátkötőket nagyon elterjedten alkalmazták világszerte a krónikus vesebetegek hyperphosphataemiájának kezelésére. Bár e készítmények hatékony foszfátkötők, számos probléma merül fel alkalmazásukkal kapcsolatosan. Több vizsgálat alapján merült fel, hogy e készítmények alkalmazása önálló rizikófaktora az adinámiás csontbetegség kialakulásának. A dializátum viszonylag magas kalciumtartalmával együttesen a nagy adagban alkalmazott kalciumtartalmú foszfátkötőkből felszívódó kalcium összességében pozitív kalciumegyensúlyt hoz létre a betegeknél, s ez részben intermittáló hypercalcaemia kialakulásához vezet, másrészt - különösen magas szérumfoszfáttal együtt hatva - szerepet játszhat a dializált betegek extraosszeális kalcifikációjának patogenezisében. Ez utóbbi ugyanakkor bonyolult folyamatok végeredménye, s minden bizonnyal hozzájárul a dializált betegek kiugróan magas cardiovascularis halálozásához.
Éppen ezért intenzív kutatások folynak olyan foszfátkötők kifejlesztése érdekében, melyek nem tartalmaznak sem kalciumot, sem a korábbi években használt s súlyos toxicitást okozó alumíniumot. E téren vasvegyületeket, lantánsókat próbáltak már ki. Igazán hatékonynak azonban mindeddig a sevelamer HCl nevű ioncserélő gyanta bizonyult, melyről több vizsgálatban is kimutatták, hogy hatékonyan csökkenti dializált betegek foszfátszintjét, s kedvező hatású volt az iPTH-szintre is. Mindemellett csökkenti a betegek koleszterinszintjét is, s jelenleg folyamatban van a betegek mortalitására kifejtett hatásának prospektív vizsgálata. Sajnos e készítmény jelenleg nem érhető el széles körben Magyarországon (beszerzése egyedi import révén lehetséges), s magas ára miatt várhatóan a későbbiekben is csak megfelelően indokolt esetekben - pl. alacsony iPTH-, magas kalcium- és foszforszint - lesz alkalmazható. Így feltehetően még sokáig kénytelenek leszünk a kalcium- és egyéb fémtartalmú foszfátkötők kombinált alkalmazására. E tekintetben leghatékonyabb foszfátkötőknek mind ez ideig az alumíniumsók bizonyultak, ugyanakkor súlyos toxicitásuk miatt csak a lehető legkisebb adagban és csak átmenetileg alkalmazhatók. A bázisterápia kiegészítésére használhatunk magnéziumtartalmú, eredetileg savkötőként alkalmazott készítményeket is. Ilyenkor azonban szorosan monitoroznunk kell a szérummagnézium-szintet.
A hyperparathyreosis kezelése krónikus vesebetegeknél
Összefoglalás
A szekunder hyperparathyreosis megelőzésében és kezelésében elsődleges fontosságú a szérum Ca és P normál tartományban való tartása.
D-hipovitaminózis fennállása esetén (30 ng/ml alatt) natív D-vitamin-pótlás javasolt, heti 6-9000 egység dózisban.
Amennyiben az iPTH meghaladja a normál tartomány ötszörösét, s a szérum Ca a normál tartományban van, és a szérum P <1,9 mmol/l, aktív D-vitamin- (1-alfa-kalcidol, kalcitriol) készítmény alkalmazása szükséges a hyperparathyreosis kezelése céljából. Az aktív D-vitamin-készítmény javasolt adagja 0,25-1 mikrogramm/nap, lehetőleg este, lefekvés előtt.
Jelenleg nem áll rendelkezésre olyan egyértelmű adat, mely alátámasztaná, hogy a parenteralisan alkalmazott kalcitriol hatékonyabb volna, vagy kevesebb mellékhatást okozna, mint orális adagolás esetén. Ezért jelenleg az orális alkalmazást javasoljuk.
Magasabb iPTH-szintek esetén per os bolusz adagolás (dialízis után 1-2 mikrogramm) hatékony lehet.
Jelenleg nincsenek olyan meggyőző klinikai adatok, melyek alátámasztanák, hogy az újabb D-vitamin-analógok (oxakalcitriol, parikalcitol, doxerkalciferol) adása előnyösebb volna, mint a hagyományos D-vitamin-származékok alkalmazása.
Aktív D-vitamin-származék akkor alkalmazható, ha a szérum iPTH meghaladja a normál tartomány 2-4-szeresét, ha a szérum Ca a normál tartományban van, és ha a szérum P <1,9 mmol/l.
Részletes rész
A korábban már tárgyalt problémák miatt - a különböző PTH-mérőmódszerek pontatlansága, a PTH-metabolizmus sajátosságai urémiás betegeknél - nem egyértelmű a szekunder hyperparathyreosis definíciója e betegpopulációban. Ennélfogva nem egyértelmű az állapot kezelésének indikációja sem, valamint viták vannak a kezelés végpontjainak meghatározásáról is. Nincsenek egyértelmű adatok tehát, melyekre építve meghatározhatnánk, hogy mely iPTH-szint esetén kezdjük el a célzott terápiát, meddig folytassuk azt, s mikor van szükség sebészi beavatkozásra. A problémát csak bonyolítja, hogy nem ismeretes egyértelműen az sem, hogy a hyperparathyreosis mely foka milyen szövődmények kialakulását eredményezi.
Említettük például, hogy a csontszövet urémiás rezisztenciája, valamint a ROD bonyolult, sokkomponensű patogenezise miatt az egyes betegeknél azonos iPTH-szint mellett teljesen eltérő, sokszor homlokegyenest különböző terápiát igénylő csontelváltozás mutatható ki. Az iPTH céltartományáról epidemiológiai adatok adnak tájékoztatást: több, részben független vizsgálat adataira építve azt mondhatjuk, hogy a normál tartomány 2-5-szörös szintje mellett legnagyobb a valószínűsége a normálhoz leginkább közel álló csontanyagcsere kialakulásának, ezért az iPTH céltartományát így határozhatjuk meg.
A hyperparathyreosis kezelésében alapvető szerepe van a szérum Ca és P normalizálásának. Emellett fontos annak biztosítása is, hogy a betegek D-vitamin-ellátottsága normális legyen, hiszen több vizsgálatban is felvetették a D-hipovitaminózis lehetséges szerepét a hyperparathyreosis kialakulásában, súlyosságának meghatározásában. Ezért a 25(OH)D3 vitaminszintjének meghatározása mellett mindenképpen javasolt a rászoruló betegeknél a vitamin pótlása, bár e megközelítés hatékonyságát prospektív vizsgálat nem támasztja alá. Amennyiben a predialízis szakban észlelt betegeknél az iPTH-szint emelkedését észleljük normophosphataemia és normocalcaemia, valamint normális D-vitamin-szint mellett, igen kis dózisú aktív D-vitamin-származék - 0,125 mikrogramm kalcitriol vagy megfelelő adagú 1-alfa-kalcidol - adásával a PTH-szint normalizálódását érhetjük el. E megközelítés következetes alkalmazásával megelőzhetjük a hyperparathyreosis súlyosbodását.
Amennyiben a dializált betegeknél az iPTH-szint emelkedésének mértéke meghaladja a normál tartomány 3-5-szörösét, a megfelelő feltételek fennállása esetén szükséges magasabb adagban alkalmazott aktív D-vitamin adását kezdeni. Ilyen esetekben a kalcitriol kezdő adagja napi 0,5 mikrogrammnak megfelelő dózis legyen, s ezt adhatjuk a dialíziskezelés után, intermittáló per os boluszkezelés formájában. Ha az iPTH-szint a normál tartomány tízszeresét is meghaladja, még nagyobb adagú - 2-4 mikrogramm - per os vagy intravénás boluszterápiával próbálkozhatunk. Mindenképpen ismételten hangsúlyoznunk kell a normophosphataemia és normocalcaemia fenntartásának jelentőségét, hiszen a kalcitriol adásakor hyperphosphataemia és hypercalcaemia együttes kialakulása esetén nagyon megnő az extraosszeális kalcifikáció veszélye, s a hyperphosphataemia paradox módon a hyperparathyreosis súlyosbodását is okozhatja. Amennyiben az intenzív D-vitamin-kezelés nem hoz eredményt, vagy e terápia során hypercalcaemia, hyperphosphataemia alakul ki, indokolt lehet a parathyreoidectomia.
Bár egyes tanulmányok alapján felmerült, hogy a parenteralis kalcitriolterápia hatékonyabb, illetőleg kevesebb mellékhatással jár, mint a per os boluszterápia, az összes rendelkezésre álló adat alapján ez nem tekinthető bizonyítottnak. Több összehasonlító vizsgálat adatai alapján azt mondhatjuk, hogy a kétféle alkalmazási mód körülbelül azonos hatékonyságú, s a mellékhatások gyakorisága is hasonló, de a per os adagolás lényegesen olcsóbb.
Ugyancsak nincs kellő klinikai tapasztalat és adat az egyes országokban már törzskönyvezett D-vitamin-analógok komparatív hatékonyságát, mellékhatásprofilját vagy költséghatékonyságát illetően, ezért ezek alkalmazása a mindennapi gyakorlatban nem tekinthető megalapozottnak. Ugyancsak experimentális stádiumban van a kalciumérzékelő receptor érzékenységét közvetlenül befolyásoló gyógyszerek, a kalcimimetikumok alkalmazása a hyperparathyreosis kezelésére.
Parathyreoidectomia
Összefoglalás
Súlyos, tüneteket okozó szekunder hyperparathyreosis (iPTH>1000 pg/ml vagy 10 pmol/l) fennállása esetén bizonyos esetekben szóba jöhet a parathyreoidectomia. A műtét megfontolandó, ha ismételt hypercalcaemia, csontfájdalmat, esetleg törést okozó osteitis fibrosa, kalcifilaxis vagy jelentős lágyrész-meszesedés alakul ki. Ilyen esetekben az extrém magas iPTH észlelésekor agresszíven törekedni kell a szérum P normalizálására, szükség szerint nagy adagban alkalmazott, kombinált foszfátkötőkkel. A feltételek fennállása esetén nagy dózisú aktív D-vitamin-származék adása szükséges. Amennyiben 2-3 hónap elteltével a tünetek és a biokémiai eltérések fennállnak, s a megfelelő vizsgálatokkal (mellékpajzsmirigy UH, MP szcintigráfia, esetleg CT) nagyobb mirigy igazolható, a műtét elvégzése szükséges.
A megfelelő feltételek fennállása esetén (a fenti indikációs feltételek mellett jól felszerelt, megfelelő minőségű UH-készülék, az eljárásban gyakorlott intervenciós radiológus) eredményes lehet a mellékpajzsmirigy-adenoma UH-vezérlés melletti etanolinjekcióval történő elroncsolása is.
Részletes rész
A mellékpajzsmirigy sebészi eltávolítása olyan dializált betegek esetében jön szóba, akiknek hyperparathyreosisra visszavezethető tünetei nem csillapíthatók, s a fenti konzervatív kezeléssel a szérum iPTH-szintje nem csökkenthető. Általánosságban azt mondhatjuk, hogy a súlyos hyperparathyreosis esetén akkor indokolt a parathyreoidectomia, ha az igen magas (>80-100 pM vagy 800-1000 pg/ml) iPTH-érték mellett:
- súlyos hypercalcaemia;
- súlyos, progrediáló osteitis fibrosa;
- súlyos, nem csillapítható viszketés;
- progresszív extraosszeális kalcifikáció vagy kalcifilaxis;
- mással nem magyarázható súlyos myopathia is fennáll, s a hyperparathyreosis az intenzív kalcitriolkezelésre nem reagált, vagy annak során hypercalcaemia vagy hyperphosphataemia alakult ki. Igen valószínű, hogy parathyreoidectomia szükséges akkor, ha az ultrahangvizsgálat során nagyméretű - 0,5-1,0 g-ot meghaladó - mellékpajzsmirigyet találunk.
A csökkent csontásványianyag-tartalom, fokozott törésveszély kezelése dializált betegeknél
Epidemiológiai adatok alapján a dializált betegeknél csökkent a csontok ásványianyag-tartalma, s az átlagpopulációhoz képest jelentős mértékben fokozott a csonttörés veszélye. Jelenleg ugyanakkor nem rendelkezünk olyan adatokkal, amelyek alátámasztanák, hogy az átlagpopulációban használatos hatékony terápiás eszközök (biszfoszfonátok) e populációban biztonságosan adhatók és hatékonyak. Így a csonttörés veszélyének csökkentése érdekében egyelőre a szérumkalcium- és -foszforszint normalizálása és a szekunder hyperparathyreosis megelőzése, illetve kezelése az alkalmazandó terápia.
A renalis anémia terápiája
A vérszegénység kivizsgálása krónikus veseelégtelenségben
A vérszegénység (anémia) okának kivizsgálása szükséges:
- ha a hemoglobin- (Hgb) szint <11 g/dl (110 g/l)/a hematokrit (Htk) értéke <33% (0,33)/menopauza előtti nőknél és pubertás előtti gyermekeknél;
- ha Hgb<12 g/dl (<120 g/l)/Htk<36% (0,36)/felnőtt férfiaknál és menopauza utáni nőknél.
Renalis anémia (eritropoetinhiány) valószínű, amennyiben a kivizsgálás során az anémia egyéb oka nem igazolódik, és a glomerulusfiltrációs ráta (GFR) vizsgálata vesefunkciós zavart igazol (GFR<30 ml/min, diabetes nephropathia esetén a GFR<45 ml/min). Az eritropoetin szintjének meghatározása rendszerint nem indokolt.
Az anémia kivizsgálásához és a kezelés hatékonyságának az ellenőrzéséhez szükséges vizsgálatok
- A vérképző szervrendszer vizsgálata: Hgb, Htk, vörösvértestindexek (MCV, MCH, MCHC), fehérvérsejtszám (fvs.), vérlemezek száma, reticulocytaszám, C-reaktív protein (CRP).
- A vasháztartás vizsgálata: szérumvas (Fe), ferritinszint, a hipokróm vörösvértestek százalékos aránya, transzferrinszaturáció meghatározása vagy kiszámítása (Tsat=Fe/TVK),
- Egyéb, kiegészítő vizsgálatok: szükség esetén javasolt B12-vitamin-szint, folsvszint meghatározása, a csontvelővizsgálat, a vvt.-morfológia, az okkult vérzés vizsgálata (székletvérteszt, endoszkópos vizsgálat), urológiai, nőgyógyászati, gasztroenterológiai, hematológiai konzílium.
- Egyéb ok gyanúja esetén további részletes vizsgálat, illetve a megfelelő oki kezelés szükséges.
A renalis anémia kezelése eritropoetinnel
A renalis anémia eritropoetinkezelésének feltételei
A renalis anémia EPO kezelését csak nefrológus szakorvos vagy a nefrológus szakorvos felügyelete alatt dolgozó nem szakorvos végezheti.
Eritropoetinkezelést csak olyan helyen végezhetnek, ahol lehetőség van az anémia kivizsgálásához és az eritropoetinkezelés hatékonyságának ellenőrzéséhez szükséges laboratóriumi és egyéb vizsgálatok teljes körű elvégzésére.
Az eritropoetinkezelés mellett kötelező a szükséges vaspótlás biztosítása.
Az eritropoetinkezelés indikációja
Az eritropoetinkezelés megkezdését akkor kell mérlegelni, ha renalis anémia esetén a hemoglobinkoncentráció konzekvensen 11 g/dl alatt van (Htk<0,33).
A veseelégtelenség és az anémia mértéke nem mindig változik arányosan, ezért renalis anémia esetén az eritropoetinkezelés gyakran indokolt krónikus veseelégtelenségben szenvedő, nem dializált (predialízis stádiumában lévő) betegnél is.
A renalis anémia eritropoetinkezelésével elérni kívánt Hgb- és Htk-érték
A cél-hemoglobinérték és cél-hematokritérték: Hgb>11 g/dl, illetve Htk>0,33. A cél-hemoglobin- és a cél-hematokritérték elérése a betegek legalább 85%-ánál szükséges. Ennek elérésével biztosítható, hogy az egész eritropoetinnel kezelt betegpopuláció átlagos hemoglobinszintje 12-12,5 g/dl között legyen.
Eritropoetinkezelés során az optimális hemoglobinszintet egyénileg kell meghatározni. Cardiovascularis betegség esetén a teljes korrekciót kerülni kell, hacsak a súlyos tünetek (pl. angina pectoris) ezt nem indokolják (az optimális hemoglobinszint e betegeknél 11,0-12,0 g/dl között van). A homozigóta sarlósejtes anémiás betegnél az optimális hemoglobinszint 7,0-9,0 g/dl közötti érték.
Az eritropoetinkezelés hatóanyagai
Eritropoetinkezelés jelenleg 3 hatóanyaggal végezhető. Ma hazánkban a biológiai hatásaikban és alkalmazásukban egyenértékű epoetin-alfa és epoetin-béta áll rendelkezésre, melyeket összefoglalva rekombináns humán eritropoetinnek (rhEPO) nevezünk. Az elmúlt években kifejlesztették a rhEPO hiperglikozilált alakját, melyet darbepoetin-alfa néven említünk. A darbepoetin-alfa eltérő farmakokinetikája miatt adagolása bizonyos szempontokból eltér a korábbi készítményekétől, ezért a különbségekkel külön pontban foglalkozunk, lásd a „Darbepoetin-alfa adagolása” c. pontot.
A rhEPO injekció beadásának módja
Szubkután vagy intravénás adagolás lehetséges. Szubkután adagoláskor kb. 25-30%-os dóziscsökkentés lehetséges az intravénás adáshoz képest. A szubkután beadási hely változtatása javasolt minden alkalommal. Kizárólagos intravénás adagolás csak speciális indikáció esetén szükséges (hemodializált gyerekeknél kifejezett „tűfóbia”, illetve a szubkután beadás helyén ismételten jelentkező haematoma esetén).
A rhEPO injekció alkalmazásának gyakorisága
Szubkután adás esetén hetente két-, háromszori alkalmazás szükséges, de alacsony dózisigény esetén (heti 6000 E vagy kevesebb) a heti egyszeri adás is megengedett, a céltartomány elérése után.
Intravénás adagolás esetén a heti háromszori adás szükséges. Mivel az eritropoetin adszorbeálódik a szintetikus dializálómembránokhoz, intravénás adáskor célszerű boluszban és a dialízis végén adni.
A rhEPO kezelés kezdő adagja
Szubkután adagolás esetén heti 60-90 E/ttkg, intravénás adagolás esetén pedig heti 100-140 E/ttkg kezdő dózis szükséges. Gyermekkorban (5 év alatt) ennél nagyobb adag javasolt.
Az anémia lassú korrekciója a mellékhatások elkerülése szempontjából fontos. Urémiában a kívánt Hgb-szintet optimálisan az átlagos (60-80 nap) vvt.-túlélési idő alatt célszerű elérni, így a kezdő dózis egyben a fenntartó adag is lehet, és ezzel elkerülhető az úgynevezett. „pingpong hematokrit szindróma”.
Az eritropoetin adagjának módosítása a szükséges dózis meghatározás során
Lassú ütemű Htk/Hgb emelkedés (Hgb<1 g/dl/4 hét, Htk<0,03/4 hét) esetén az adag emelése javasolt. Gyors Htk/Hgb emelkedés (Hgb>2 g/dl/4 hét, Htk>0,06/4 hét) esetén adagcsökkentés szükséges. A heti adagot egyszerre csak 25-50%-kal módosítsuk, ez történhet az egyes adagok módosításával vagy a gyakoriság változtatásával egyaránt (szubkután adagoláskor).
Perioperatív vagy interkurrens betegség miatt az eritropoetin dózismódosítása
Az eritropoetin adagjának módosítását mindig egyénileg kell elbírálni. Az esetleg szükséges transzfúzió adása mellett legalább a korábbi adag folytatása (vagy emelt adag adása) javasolt; helytelen ilyenkor a kezelés abbahagyása.
A Hgb- és Htk-szint monitorozása az eritropoetinkezelés alatt
Az eritropoetinkezelés elkezdése, illetve az adagváltoztatások után, 1-2 hetente szükséges a Hgb/Htk vizsgálata. Ha a cél-hemoglobinérték fenntartásához szükséges adagot elértük, akkor 2-4 hetente szükséges az ellenőrzés.
Hemodializált betegek esetében a mintavételt a dialíziskezelés megkezdése előtt végezzük.
Darbepoetin-alfa adagolása
Predialízis stádiumában és peritonealis dialízissel kezelteknél szubkután adás javasolt, hemodializáltaknál a szubkután vagy intravénás kezelés egyaránt választható. A darbepoetin hatékonyságát az alkalmazás módja nem befolyásolja.
A kezdő adag heti 1x0,45 g/ttkg szubkután, ill. intravénás adás esetén egyaránt. A Hgb monitorozása, dózismódosítása a rhEPO-hoz hasonló módon javasolt.
Ha a Hgb>14 g/dl, akkor a kezelés szüneteltetése javasolt addig, míg 13 g/dl alá nem csökken. Ekkor a korábbinál 25%-kal kisebb adagban javasolt ismételt elkezdése. Fenntartó kezelés esetén, ha a heti adag 30 g vagy kisebb, akkor a kétheti dózis egyszerre, kéthetente történő beadása is megengedhető.
Áttérés rhEPO kezelésről darbepoetin-alfa adására
A áttéréskor alkalmazandó átszámítási faktor: 200 E rhEPO = 1 g darbepoetin-alfa. Heti átszámított összadagnak megfelelő darbepoetin-alfát korábban heti 2-3-szor rhEPO-t kapó betegek esetében hetente egyszerre, korábban heti egyszer rhEPO-t kapók esetében kéthetente egyszerre javasolt adni.
Az eritropoetinkezelés hatékonyságát és eredményességét fokozó tényezők
A fizikai aktivitás javítja az oxigén hasznosulását, ezért minden betegnél javasolt a rendszeres fizikai aktivitás. Normális táplálkozás mellett B12-vitamin- és folsavpótlás nem szükséges, hemodializált betegeknél azonban a folyamatos folsavvesztés és a homocystinaemia miatt, napi 1 mg folsav rendszeres bevitele ajánlott.
Vaspótlás az eritropoetinkezelés mellett
A vaspótlás szükségességének oka
Az eritropoetinkezelés jelentősen fokozza a vasszükségletet, amellyel a felszívódás nem tud lépést tartani, különösen hemodializált betegeknél, akiknél más okból bekövetkező vérvesztés is fokozza az anémiát és a vashiányt.
A szervezet rendelkezésére álló vasmennyiség csökkenése a vasraktárak kimerüléséhez, az abszolút vashiányhoz vezet. Funkcionális vashiány alatt azt az állapotot értjük, amikor - az egyébként normális vasraktárak ellenére - a fokozott erythropoiesissel (dializált betegeknél az eritropoetinkezelés hatására) a vörösvérsejtekbe történő vasbeépülés nem tud lépést tartani.
A vasanyagcsere/vasháztartás vizsgálatának módszere
A vasanyagcsere követésére a szérumvas, valamint a szérumferritin és a hipokróm vörösvértestek százalékos arányának (amennyiben rendelkezésre áll a módszer) párhuzamos meghatározása szükséges. A hipokróm vörösvértestek százalékos arányát meghatározó módszer hiányában a transzferrinszaturáció (Tsat) meghatározása (mérés vagy számítás) javasolt.
A ferritin a vasraktárakban tárolt vas mennyiségét jelenti (a ferritin szintje emelkedett lehet akut és krónikus gyulladásokban is). A Tsat a vérképzés számára könnyen rendelkezésre álló vasmennyiséget jelenti. A hipokróm vörösvértestek százalékos aránya a keringő vörösvértestekbe történő vasbeépülést jelzi.
A vasanyagcsere/vasháztartás vizsgálatának javasolt gyakorisága
Az eritropoetinkezelés kezdetén havonta, a kívánt Htk/Hgb elérése után 3 havonta szükséges a vasanyagcsere állapotára vonatkozó paraméterek vizsgálata (ferritin, transzferrinszaturáció, hipokróm vörösvérsejtek százalékos aránya).
Parenteralis vaspótlásban részesülő beteg esetében legalább egy hétnek kell eltelnie az injekció beadása és a vérvétel között.
A vaspótlás célja, a vasanyagcsere állapotát jelző paraméterek kívánt szintje
A krónikus veseelégtelenségben szenvedő beteg megfelelő vasellátottságát az jelzi, hogy a cél Htk/Hgb elérése és fenntartása átlagos adagú eritropoetinnel biztosítható renalis anémiában, miközben a transzferrinszaturáció 20% felett, a ferritin szérumkoncentrációja 100 μg/l felett, a hipokróm vörösvérsejtek százalékos aránya pedig 5% alatt marad.
A vashiány kritériumai
Eritropoetinkezelés mellett abszolút vashiányról akkor beszélünk, ha a transzferrinszaturáció kisebb 20%-nál, és a szérumferritin koncentrációja kisebb, mint 100 μg/l.
Eritropoetinkezelés mellett fellépő funkcionális vashiány esetén a transzferrinszaturáció kisebb, mint 20% és a szérumferritin koncentrációja nagyobb 100 μg/l-nél.
Vashiányra utal, ha a keringésbe jutó hipokróm vörösvérsejtek százalékos aránya nagyobb, mint 5%. 10% feletti érték a vashiány biztos jele.
Gyulladásos betegség fennállásakor a vasanyagcsere vizsgálati paraméterei a funkcionális vashiányhoz hasonló értékeket mutatnak, ezen állapot felismerésében az egyéb lehetőségek mellett segíthet a C-reaktív protein (CRP) meghatározása (gyulladás esetén emelkedett).
A vaspótlás indikációja/kontraindikációja
Eritropoetinkezelés mellett minden esetben vaspótlást (telítő vagy fenntartó adagú) kell alkalmazni.
Vastúlterhelés (haemosiderosis) esetében ne adjunk vasat. A klinikai adatokon kívül a haemosiderosis mellett szól, ha a Tsat>0,6 és a ferritinkoncentráció >800 μg/l, egyéb májbetegség, illetve gyulladás, fertőzés hiányában.
Haemosiderosis primer haemochromatosisban, valamint a rendszeres, gyakori transzfúziók és parenteralis vas adása következtében alakulhat ki. Ha a haemosiderosis fennállása kérdéses, csontvelő- vagy májbiopszia, illetve a máj komputertomográfiás vizsgálata javasolt.
A vaspótlás módja
Eritropoetinkezelés mellett a vashiányt parenteralis készítménnyel kell pótolni, mert az orális pótlás a legtöbb esetben nem tudja a kívánt Htk/Hgb és vasszinteket fenntartani. Fenntartó vaspótlás predialízisben és peritonealis dialízis mellett orális készítménnyel javasolt, de ha a hatás nem kielégítő, akkor parenteralis adagolásra történő váltás szükséges.
Alacsony eritropoetinszükséglet esetén hemodializált betegnél is megpróbálható az orális vaspótlás, azonban minden esetben át kell térni a parenteralis pótlásra, ha a kívánt vasanyagcsere-állapotot nem érjük el.
A parenteralis vaspótlás készítményei
Hazánkban parenteralis vaspótlásra jelenleg a ferri gluconicum 5 ml/62,5 mg Fe3+ elemivas-tartalmú és a ferrum hydroxid sacharos 5 ml/100 mg Fe3+ elemivas-tartalmú injekció alkalmas.
Bármely vasinjekciót lassú boluszban (>5 perc) vagy mikroinfúzióban kell alkalmazni a dialíziskezelés végén. Hipotónia jelentkezése esetén még lassabb, akár az egész dialíziskezelés időtartamára elnyújtott adás javasolt (a transzferrin túltelítése, a szabad vas csökkentése céljából).
A parenteralis vaskészítmény adagolása
Telítő vaspótlás: Abszolút vashiányban összesen 10 ampulla, funkcionális vashiányban összesen 5 ampulla vasinjekció heti háromszori adása javasolt. Ezt követően, legalább egy hét szünet után, a vasanyagcsere vizsgálata szükséges. A vashiány további fennállása esetén újabb 5 ampulla adandó hasonló módon.
Fenntartó vaspótlás: Amennyiben a kívánt cél Htk/Hgb értékét és a vasháztartás kívánt szintjét elértük, fenntartó adagként hetente/kéthetente 1 ampulla vasinjekció adása javasolt (pl. 2 hetente 1 ampulla vagy hetente 1 ampulla tíz héten keresztül, majd 3 hét szünet).
A jelenleg elérhető intravénás készítményeket a 12. táblázat tartalmazza.
Az orális vaskészítmény adagolása
Orális vaspótlás során felnőtteknek napi 200 mg elemi vasnak (Fe2+) megfelelő készítményt kell biztosítani. A gyermekek napi igénye 2-3 mg/ttkg. A napi adagot 2-3 részletben, lehetőleg éhgyomorra kell bevenni.
A jelenleg forgalomban lévő, szájon keresztül alkalmazható készítményeket a 13. táblázat tartalmazza.
Eritropoetinnel szembeni rezisztencia
Az eritropoetin-rezisztencia fogalma
Eritropoetinnel szembeni rezisztenciáról beszélünk, ha a cél Htk/Hgb érték fenntartása heti 200 E/ttkg szubkután adott rhEPO vagy heti 1 g/ttkg darbepoetin-alfa mennyiségnél nagyobb adagot igényel.
Az eritropoetinrezisztencia lehetséges okai
Az eritropoetinrezisztencia leggyakoribb oka a vashiány (lásd a „Vaspótlás az eritropoetinkezelés mellett” c. fejezetet). A megfelelő vasellátás mellett jelentkező rezisztencia esetében leginkább akut vagy krónikus infekcióra, gyulladásra, malignus betegségre, illetve okkult vérvesztésre kell gondolnunk.
Ki kell zárnunk a súlyos hyperparathyreosist, a malnutritiót és a nem kellő hatékonyságú dialíziskezelést is. Ritkábban hemolízis, B12-vitamin- vagy folsavhiány, terhesség, alumíniumintoxikáció, csontvelő-diszfunkció okozza az eritropoetinnel szembeni rezisztenciát.
Szűrővizsgálatok eritropoetin-rezisztenciában
Eritropoetinrezisztenciában minden esetben kivizsgálás szükséges. Szűrővizsgálatként „Az anémia kivizsgálásához és a kezelés hatékonyságának az ellenőrzéséhez szükséges vizsgálatok” c. pontban megadottak és a parathormon meghatározása, a dialízis hatékonyságának és a beteg tápláltsági állapotának ellenőrzése, valamint fogamzókorú nőbetegnél a terhesség kizárása is szükséges.
Teendő pozitív szűrővizsgálati eredmény esetén
Pozitív szűrővizsgálati eredmény esetén a felmerült ok további vizsgálata és kezelése javasolt, szükség esetén a társszakmák bevonásával (lásd az „Okok, javasolt vizsgálatok és teendők eritropoetinrezisztenciában” c. pontot).
Telítő vaspróba EPO rezisztenciában
Amennyiben a szűrővizsgálatok során a rezisztencia oka nem mutatható ki, telítő vaspótlás megpróbálása szükséges (normális vasszint mellett és a haemosiderosis kizárásával). Ha ezt követően a Htk/Hgb emelkedik, ez arra utal, hogy az eritropoetinrezisztenciát a normális vasparaméterek ellenére vashiány okozza, ezért a vaspótlás intenzitásának fokozása szükséges.
Eredménytelen vaspróba után hematológiai konzílium javasolt.
Dózismódosítás EPO rezisztenciában
A legtöbb esetben az eritropoetinrezisztencia csak a kiváltó ok kezelése után szűnik meg, ezért további dózisemelés felesleges (kivétel a terhesség). A kezelés abbahagyása megfontolandó gyakori transzfúziós igény esetén (pl. haemoglobinopathiák, előrehaladott myeloma multiplex). A legtöbb esetben a korábbi dózis folytatandó, az oki kezelés mellett.
Lehetséges mellékhatások EPO kezelés során
Az eritropoetinkezelés a korábban feltételezetteknél/gondoltaknál kevesebb mellékhatással jár.
Hipertónia jelentkezése vagy súlyosbodása
A betegek kevesebb mint 20%-ánál jelentkezik, elsősorban az anémia gyorsan történő korrigálásakor. Emiatt minden eritropoetinkezelés elkezdése után a vérnyomás fokozottabb ellenőrzése szükséges.
Hipertónia jelentkezése esetén a szükséges teendők:
- az antihipertenzív szerek adagjának emelése,
- dializált beteg esetében az ún. „száraz testsúly” lehető legalacsonyabb szinten tartása,
- az eritropoetin adagjának csökkentése, nem befolyásolható (refrakter) esetekben a kezelés felfüggesztése.
Fokozott trombózishajlam
Nincs meggyőző adat arra vonatkozóan, hogy az eritropoetinkezelés a jelenlegi cél Htk/Hgb értékek mellett növelné a natív fisztulák, illetve érgraftok trombózisos elzáródásának veszélyét. Ez a szövődmény elsősorban a rosszul funkcionáló fisztulák esetén várható, ilyenkor műtéti korrekció, újabb fisztula készítése javasolt. Az extracorporalis rendszer fokozott alvadékonysága is elsősorban alacsony vérátfolyás esetén jelentkezik, ezért ezekben az esetekben szükséges lehet a heparin adagjának emelése.
Transzfúzió adása eritropoetinkezelés mellett
Eritropoetinkezelés mellett adott transzfúzió indikációja
- Hirtelen kialakuló, jelentős tüneteket okozó súlyos anémia eritropoetinkezelés mellett.
- Eritropoetinrezisztencia esetén.
- Eritropoetinnel kezelt beteg, vesetranszplantáció előtt.
A transzfúzió beadásának módja
A transzfúzió beadása a Transzfúziós szabályzatban (Országos Vérellátó Szolgálat, 1998.) rögzítettek szerint történhet.
Okok, javasolt vizsgálatok és teendők eritropoetinrezisztenciában
Krónikus vérvesztés
Okok: fokozott vérzékenység az urémiás thrombocytopathia vagy a heparinkezelés miatt. Gyakori az okkult gastrointestinalis vérzés, a dialíziskezeléssel, illetve a vérvételekkel kapcsolatos vérvesztés.
Vizsgálatok: székletvérteszt, reticulocytavizsgálat, endoszkópia.
Teendők: a felesleges vérvételek kerülése, a heparinkezelés optimalizálása, hisztamin-2 típusú receptorblokkoló, illetve protonpumpagátló készítmény adása (empirikusan is) javasolt a fokozott menstruációs vérzés kezelése.
Akut vagy krónikus fertőzés, gyulladás vagy malignus betegség
Okok: a vasfelszabadulás gátlása (a reticuloendothelialis sejtraktárból történő felszabadulás gátlása), a cytokinek gátló hatása.
Vizsgálatok: Szűrővizsgálatként a C-reaktív protein vizsgálata javasolt (a vörösvérsejt-süllyedés értéke gyakran álpozitív). Pozitív esetben hemokultúra, vizelet bakteriális tenyésztés, Mantoux-próba, ALP, LDH, PSA, mellkas- és arcüregröntgen, hasi ultrahang és/vagy komputertomográfiás vizsgálat, szívultrahang, konzíliumok (nőgyógyászati, urológiai, fogászati, fül-orr-gégészeti) és esetleg jelzett leukocytákkal végzett szcintigráfia javasolt, az okkult fertőzések (pl. abscessus, veseciszta-infekció, endocarditis lenta), illetve a daganatos betegségek kizárása céljából. Immunpatogenezisű betegség gyanújakor immunszerológia végzése szükséges (ANCA, ANA, RF, LE).
Teendők: a fertőzés adekvát antibiotikus kezelése, aktív immunfolyamatban (vasculitis, SLE, rheumatoid arthritis, graft rejectio) szteroid és immunszuppresszív szerek adása javasolt, szükség esetén graftektómia.
Hyperparathyreosis
Okok: a parathormon direkt gátló hatása a csontvelői vérképzésre és az endogén eritropoetinképzésre, a csontvelő fibrosisa.
Vizsgálatok: szérumparathormon-szint, alkalikus foszfatáz, kalcium és foszfor koncentrációjának meghatározása, nyaki/mellékpajzsmirigy ultrahangvizsgálata és csontröntgenvizsgálat.
Teendők: intravénás kalcitriol adása, mellékpajzsmirigy eltávolítása.
Alultápláltság, nem kellően hatékony dialíziskezelés
Okok: a csontvelői vérképzést gátló retenciós anyagok felszaporodása (súlyos urémia), a vérképzéshez szükséges vitaminok/fehérjék hiánya.
Vizsgálatok: a szérum-karbamidnitrogén, -kreatinin, -albumin meghatározása, az urea redukciós ráta (URR) és a Kt/V érték számítása, antropometriai vizsgálat.
Teendők: a dialíziskezelés hatékonyságának fokozása, szükség esetén új fisztula készítése, roboráló/mesterséges táplálás, ketosavak pótlása.
Hemolízis
Okok: csökkent vörösvérsejt-élettartam, extracorpuscularis (hypersplenia, mérgek, gyógyszer, fertőzés, autoimmun betegség) vagy intracorpuscularis (membrándefektus, enzimdefektus, haemoglobinopathia) okok következtében.
Vizsgálatok: reticulocyta, kvalitatív vérkép (fragmentocyták), haptoglobin, LDH, szérumbilirubin meghatározása, Coombs-teszt, vörösvérsejt-rezisztencia, glükóz-6-foszfát-dehidrogenáz, Hgb-elektroforézis.
Teendők: a feltételezett károsító gyógyszer kihagyása (alfa-methyldopa, penicillinek), a dializálóoldat ellenőrzése, Coombs-pozitivitás esetén szteroid, kifejezett hypersplenia esetén splenectomia javasolt.
B12-vitamin- és/vagy folsavhiány
Okok: hatástalan erythropoesis, megaloblastos vérképzés.
Vizsgálatok: átlagos vörösvérsejt-térfogat (MCV), B12-vitamin- és folsavszint meghatározása, Schilling-próba.
Teendők: szájon keresztüli, illetve szükség esetén parenteralis folsav- és B12-vitamin-pótlás.
Terhesség
Ok: fokozott EPO igény.
Vizsgálatok: nőgyógyászati ultrahangvizsgálat és szülész-nőgyógyász konzílium.
Teendők: döntés a terhesség kiviseléséről, vállalása esetén az eritropoetin adagjának és dialíziskezelés „dózisának” emelése javasolt, a terhesség megszakítását követően fogamzásgátlás szükséges.
Alumíniumintoxikáció
Okok: az alumínium vasanyagcserével történő interferenciája, a hem szintézis gátlása.
Vizsgálatok: szérum alumíniumkoncentrációjának meghatározása, desferrioxaminteszt.
Teendők: az alumíniumtartalmú gyógyszerek (foszfátkötők, sucralfat) szedésének kerülése, s dializálófolyadék alumíniumtartalmának ellenőrzése, desferroxiamin adása.
Csontvelő-diszfunkció
Okok: tumoros infiltráció, myelodysplasia, anaemia aplastica.
Vizsgálatok: hematológiai konzílium, csontvelő-biopszia.
Teendők: alapbetegség kezelése, eritropoetinszint emelése vagy abbahagyása.
Vörösvérsejt-aplázia („pure red-cell aplasia”)
Oka: neutralizáló eritropoetinellenes antitestek kialakulása.
Vizsgálatok: reticulocytopenia, csontvelő-biopszia: erythroblastok csaknem teljes hiánya az egyébként normális csontvelőben.
Teendők: eritropoetinkezelés (bármelyik készítmény) azonnali teljes abbahagyása, transzfundálás, immunszuppresszív kezelés megfontolása.
12. táblázat A vesepótló kezelésben részesülő betegeknek biztosított eritropoetintartalmú készítmények Magyarországon
| Gyógyszernév | Gyógyszerforma | ATC-besorolás | Hatóanyag |
|---|
| Eprex 1000 NE | inj fecskendőben (HSA-mentes) | B03X A01 | eritropoetin-alfa |
| Eprex 2000 NE | inj fecskendőben (HSA-mentes) | B03X A01 | eritropoetin-alfa |
| Eprex 3000 NE | inj fecskendőben (HSA-mentes) | B03X A01 | eritropoetin-alfa |
| Eprex 4000 NE | inj fecskendőben (HSA-mentes) | B03X A01 | eritropoetin-alfa |
| NeoRecormon 1000 NE | inj előretöltött fecskendőben | B03X A01 | eritropoetin-béta |
| NeoRecormon 2000 NE | inj előretöltött fecskendőben | B03X A01 | eritropoetin-béta |
| NeoRecormon 5000 NE | inj előretöltött fecskendőben | B03X A01 | eritropoetin-béta |
| NeoRecormon 6000 NE | inj előretöltött fecskendőben | B03X A01 | eritropoetin-béta |
13. táblázat Magyarországon forgalomban lévő*, vaspótlásra alkalmas készítmények
| Gyógyszernév | Gyógyszerforma | ATC-besorolás | Vashatóanyag | Vastartalom
mg | Elemivas-tartalom
mg | Folsav-tartalom
mg |
|---|
| Aktiferrin | kapszula | B03A A07 | ferrosum sulfuricum | 113,85 | 34,5 | |
| Aktiferrin | csepp | B03A A07 | ferrosum sulfuricum | 1416 | 280 | |
| Aktiferrin | szirup | B03A A07 | ferrosum sulfuricum | 3420 | 680 | |
| Ferro-Folgamma | kapszula | | ferrosum sulfuricum anhydricum | 100 | 37 | 5 |
| Ferro-Gradumet | filmtabletta | B03A A07 | ferrosum sulfuricum siccatum | 325 | 105 | |
| Ferrograd Folic | filmtabletta | B03A D03 | ferrosum sulfuricum siccatum | 325 | 105 | 0,35 |
| Makrofer | pezsgőtabletta | B03A A03 | ferrum gluconicum | 695 | 80 | |
| Maltofer | cseppek | B03A B05 | ferrum hydroxydatum | | 50 | |
| Maltofer | rágótabletta | B03A B05 | ferrum hydroxydatum | | | |
| Maltofer | szirup | B03A B05 | ferrum hydroxydatum | | 10 | |
| Maltofer Fol | rágótabletta | B03A D19 | ferrum hydroxydatum | | 100 | 0,35 |
| Sorbifer durules | filmtabletta | B03A A07 | ferrosum sulfuricum siccum | 320 | 100 | |
| Tardyferon | drazsé | B03A A07 | ferrosum sulfuricum sesquihydricum | 256,3 | 80 | |
| Tardyferon Fol | retard drazsé | ferrosum sulfuricum sesquihydricum | 256,3 | 80 | 0,35 | |
| Intravénás készítmények |
|---|
| Ferrlecit | injekció | B03A C19 | natrium ferrigluconicum | | 62,5 | |
| Venofer | injekció | ferrum hydroxid sacharos | | | 100 | |
* Az összefoglalás nem tartalmazza a vastartalmú köptetőket és vitaminkészítményeket, valamint a csak intramuscularisan adható Jectofer injekciót.
A hyperlipidaemia terápiája krónikus veseelégtelenségben
Az idült veseelégtelenség (CVE) és a lipidanyagcsere kapcsolata
Idült veseelégtelenség esetén észlelhető lipideltérések
A kiváltó októl függetlenül, már a veseelégtelenség korai szakában kóros változások kezdődnek a zsíranyagcserében. A dyslipidaemia leggyakrabban a triglicerid (TG) emelkedésében és a HDL-koleszterin (HDL-C) csökkenésében mutatkozik. Ha az alapbetegség jelentős proteinuriával is jár, akkor ezekhez az LDL-koleszterin (LDL-C) és az összkoleszterin (TC) emelkedése is társul. Urémiában az LDL-C koncentrációja többnyire normális, azonban a minőségi összetétele kedvezőtlenül változik, megnő a nagy atherogenitasú, kicsiny, denz LDL-partikulumok mennyisége. A lipoproteinek alkotóelemei a fokozott oxidatív és karbonilstressz következtében módosulhatnak, ezáltal hosszabb ideig maradnak a keringésben.
Dyslipidaemia következményei idült veseelégtelenségben
Az idült veseelégtelen betegeket a lipidszinttől függetlenül a legnagyobb kockázatú csoportba kell sorolni a cardiovascularis megbetegedések szempontjából e betegségek igen nagy gyakorisága miatt. A kardiális halálozás a dializált betegeknél az átlagpopulációhoz képest 10-20-szor gyakoribb.
A cardiovascularis betegségek gyakorisága és mortalitása még magasabb a diabéteszes dializált betegek körében.
Az általános populációban mára bizonyítottá vált, hogy az emelkedett LDL-C-, a csökkent HDL-C-, illetve az emelkedett TG-szint is a coronariabetegség független rizikótényezői, és kedvező befolyásolásuk révén a mortalitás csökkenthető. Ezért valószínűleg a CVE során észlelhető mennyiségi és minőségi lipideltérések összességében szintén közrejátszanak a veseelégtelen betegek fokozott atherosclerosis hajlamában, bár ezt eddig egyértelműen, prospektív tanulmányokban nem igazolták.
A dyslipidaemiának szerepe lehet a veseelégtelenség progressziójában is; a lipidcsökkentés mérsékelt CVE esetén, ill. vesetranszplantáció után elősegítheti a GFR megőrzését, a proteinuria csökkentését.
A lipidanyagcsere vizsgálata idült veseelégtelenségben
A vizsgálat indikációi, gyakorisága
A veseelégtelen betegek a cardiovascularis szövődmények szempontjából a legnagyobb rizikójú csoportba tartoznak, ami azt jelenti, hogy 10 éven belül a cardiovascularis betegségek kockázata 20% feletti. Ilyen esetekben az NCEP-ATP III. ajánlása alapján már tünetmentes esetben is indokolt a lipidcsökkentő kezelés. Ezért klinikailag tünetek (ISZB, érmanifesztációk) hiányában is indokolt a lipidanyagcsere vizsgálata minden idült veseelégtelen felnőtt betegnél. A vizsgálatot a nefrológiai gondozásba, ill. dialízisprogramba való vételkor, valamint rendszeresen félévente javasolt elvégezni.
Vizsgálandó paraméterek
Minden veseelégtelen betegnél az összkoleszterin, a triglicerid, a HDL-koleszterin és az LDL-koleszterin éhgyomri vizsgálata szükséges. Jelentős proteinuria esetén, valamint egyes betegeknél indokolt lehet a lipoprotein(a) vizsgálata is.
Amennyiben a vizsgálat nem éhgyomorral történt, akkor kizárólag a TC és a HDL-C értékelhető. Ebben az esetben a vizsgálat éhgyomri ismétlése akkor szükséges, ha TC>5,2 mmol/l, vagy HDL-C<1,0 mmol/l, vagy TC mínusz HDL-C>3,4 mmol/l.
Dyslipidaemia megállapítása, idült veseelégtelenségben kívánatos lipidparaméterek
A idült veseelégtelenségben dyslipidaemiát állapíthatunk meg, ha a TC>5,2, LDL-C>2,6 mmol/l és/vagy a TG>2,3 mmol/l, illetve a HDL-C<1,0 mmol/l.
A legnagyobb kockázatú csoportban, ill. manifeszt cardiovascularis megbetegedésben a kívánt LDL-C-szintet az új ajánlások 2,6 mmol/l alattiban jelölik meg, ezt tekintjük elsődlegesen elérendő célnak idült veseelégtelenségben is. A kockázatot egyértelműen fokozza a magas TG-, illetve az alacsony HDL-C-szint. Hypertriglyceridaemia esetén a legnagyobb kockázatú csoportban a NCEP-ATP III. ajánlása szerint a kezelés másodlagos célja a nem HDL-koleszterin (TC mínusz HDL-C) 3,4 mmol/l alá csökkentése.
Dyslipidaemiát okozó egyéb okok keresése
Emelkedett LDL-C és TC esetén tisztázandó a vizelettel történő fehérjevesztés mértéke. Idült veseelégtelenségben a glomerularis filtrációs ráta csökkenése ellenére is jelentős (1,0 g/nap feletti) lehet a proteinuria, elsősorban a primer glomerularis alapbetegségek, ill. a szekunder módon kialakult fokális glomerulosclerosis eseteiben. A fehérjevesztés miatt a májban fokozódik a lipoproteinek termelése a hypalbuminaemia (nephrosissyndroma) nélküli esetekben is.
Emelkedett TG-szint (és rendszerint alacsony HDL-C) az idült veseelégtelenségen kívül gyakran obesitasban, diabetes mellitusban, metabolikus szindrómában fordul elő, de gondolni kell excesszív alkohol-, ill. szénhidrátfogyasztásra, hypothyreosisra is.
Egyes esetekben az alkalmazott gyógyszerek gyakorolnak kedvezőtlen hatást a lipidanyagcserére. A nefrológiai gyakorlat szempontjából leggyakrabban a glükokortikoidok, a cyclosporin és a nagy adagú tiazid diuretikumok/béta-receptor blokkolók alkalmazásakor kell erre figyelnünk.
Ritkán genetikai tényezők is szerepet játszanak a lipidzavarokban.
Elsődleges teendők, a lipidzavarok közvetett befolyásolásának lehetőségei idült veseelégtelenségben
Testsúlycsökkentés és életmódbeli tanácsok
Dyslipidaemia észlelése során idült veseelégtelenségben is alkalmaznunk kell az általános populációra vonatkozó javaslatokat, de a speciális körülményeket figyelembe kell venni. Mindenkinek ajánlott a dohányzás abbahagyása, az alkoholfogyasztás mérséklése (maximum napi 1,5 dl bor vagy 3 dl sör) és a fizikai aktivitás fokozása.
Elhízás esetén minden veseelégtelen betegnél, de különösen hangsúlyozottan 2. típusú diabetes mellitusban és veseátültetés után, feltétlenül törekedni kell a testsúlycsökkentésre, az ideális testsúly elérésére.
Társuló rendellenességek kezelése
Diabetes mellitusban a szénhidrátháztartás jobb beállítása egyaránt csökkenti az LDL-C-, TC- és TG-szinteket.
A jelentős proteinuria mérséklése szintén csökkenti a lipidszinteket. E célból elsősorban fehérjeszegény diéta alkalmazása, ill. ACE-gátló/AIIRA és/vagy verapamil vagy diltiazem típusú kalciumcsatorna-gátlók adása javasolt.
A lipidanyagcserét kedvezőtlenül befolyásoló gyógyszer szedése esetén bizonyos esetekben mérlegelendő annak kihagyása, más gyógyszerrel történő helyettesítése.
A dyslipidaemia diétás kezelése
A diétás változtatások javaslatakor figyelembe kell venni a veseelégtelen betegeknél egyébként alkalmazott komplex diétás szükségleteket. A megfelelően összeállított vesebeteg-diéta közel áll az optimális lipidcsökkentő javaslatokhoz. Ugyanakkor, elsősorban a dialízis stádiumában, gyakori az elégtelen energiabevitel, és a malnutritio rontja a betegek túlélési esélyeit.
Emiatt a hemodializált betegek esetében megengedett, bizonyos esetekben szükséges a nagyobb, a teljes energiaigény 35-40%-át biztosító zsírbevitel. Peritonealis dialízissel kezeltek a dializáló glükózoldatokból pluszenergiát nyernek, így esetükben a zsírbevitel az általános populációban javasoltnak megfelelő legyen, ne haladja meg az energiaigény 30%-át. A veseelégtelen betegek esetében is elsősorban a telített zsírok bevitelét kell korlátoznunk, ezek aránya maximum harmada legyen a teljes zsírbevitelének.
CVE esetén a diétás kezeléssel a betegek jelentős többségénél nem tudunk eredményt elérni.
Dialíziskezelés módosítása
Hemodializált betegeknél a high-flux membránok kedvezően befolyásolják a dyslipidaemiát. Ebben valószínűleg az LDL oxidatív módosulásában szerepet játszó reaktív késői glikációs végtermékek, valamint az urémiában felszaporodó lipázgátló fokozott eltávolítása játszik szerepet. Ezért társuló cardiovascularis betegségben, valamint fiatal, transzplantációra nem alkalmas betegeknél törekedni kell e membránok alkalmazására.
A hagyományos Na-heparinnal szemben előnyös lehet az alacsony molekulasúlyú heparin alkalmazása, mivel a lipidanyagcserét kevésbé tolja el a dyslipidaemia irányába.
Lipidcsökkentő gyógyszeres kezelés idült veseelégtelenségben
A kezelés indikációi idült veseelégtelenségben
Amennyiben várható, hogy az „Elsődleges teendők, a lipidzavarok közvetett befolyásolásának lehetőségei idült veseelégtelenségben” c. pontban vázolt elsődleges beavatkozások hatásosak lesznek, úgy a lipidvizsgálatok 2-3 hónap múlva ismétlendőek. Ha a dyslipidaemia (lásd a „Dyslipidaemia megállapítása, idült veseelégtelenségben kívánatos lipidparaméterek” c. pontot) ekkor is fennáll, mérlegelni kell a lipidcsökkentő gyógyszeres kezelést. Amennyiben e beavatkozásokra nincs lehetőség, ill. a lipidzavar súlyossága vagy a beteg állapota (pl. myocardialis infarktus utáni állapot) igényli, akkor a lipidcsökkentő gyógyszeres kezelés azonnal, a diétás, ill. egyéb kezeléssel egy időben elkezdhető.
Gyógyszeres lipidcsökkentő kezelés javasolt minden esetben, akkor is, ha cardiovascularis betegség (még) nem igazolható, ha az LDL-C>3,4 mmol/l és/vagy a TG>3,4 mmol/l.
Ennél kisebb mértékű dyslipidaemia (LDL-C>2,6 mmol/l és/vagy TG>2,3 mmol/l) esetén is mérlegelendő a gyógyszeres kezelés elkezdése, ha cardiovascularis betegség igazolható.
Gyógyszeres kezelés módjai idült veseelégtelenségben
Hypercholesterinaemiában vagy kombinált hyperlipidaemiában sztatin adása javasolt, az adagot lényegesen nem kell csökkenteni, de a gyógyszer-interakciókra figyelni kell.
Jelentős hypertriglyceridaemiában (>4,5 mmol/l) elsősorban fibrát adása javasolt a vesefunkciónak megfelelően jelentősen csökkentett adagban.
Sztatin és fibrát kombinált adása már mérsékelt veseelégtelenségben is ellenjavallt a rhabdomyolysis jelentősen nagyobb kockázata miatt.
Sztatinok adása
Valamennyi hazánkban elérhető sztatinkészítmény alkalmazható idült veseelégtelenségben. Elsősorban a májban metabolizálódnak, így veseelégtelenségben lényeges dóziscsökkentés nem szükséges. Kifejezetten beszűkült vesefunkció esetén (20 ml/min Ccr alatt) azonban már ne alkalmazzunk maximális adagot (14. táblázat).
A rhabdomyolysis (RML) elkerülése céljából fokozottan figyelni kell a gyógyszer-interakciókra.
A veszély kisebb a fluvasztatin adása során, a májban történő eltérő metabolizmusa miatt, így inkább ez választandó az elkerülhetetlen kombinációk (pl. cyclosporint szedő transzplantált beteg) esetén. A választásban figyelembe vehetjük kissé eltérő hatásaikat is, pl. a szimvasztatin jobban emeli a HDL-C-t, az atorvasztatin jobban csökkenti a trigliceridet.
Fibrátok adása
A fibrátok veseelégtelenségben kumulálódnak, és így önmagukban is myopathiát, rhabdomyolysist okozhatnak. Mindegyik hazánkban elérhető fibrátderivátummal kapcsolatban észlelték már RML kialakulását, de ennek lehetőségét a modern, II-III. generációs retard készítmények alkalmazása jelentősen emeli. Ezért már mérsékelt veseelégtelenségben (Ccr 30-60 ml/min) csökkentsük a fibrátok adagját kétharmadára-felére, és lehetőleg kerüljük a retard készítmény adását, pl. mikronizált helyett adjunk standard fenofibrátot vagy retard helyett hagyományos gemfibrozilt vagy bezafibrátot. Súlyos veseelégtelenségben (Ccr<20 ml/min) csak ezek a standard készítmények adhatók, de a dózist még tovább kell csökkenteni a szokásos adag harmadára (15. táblázat).
A kezelés hatásosságának és biztonságának ellenőrzése
A kezelés elkezdésekor a beteg figyelmét fel kell hívni az esetleges mellékhatások tüneteire, különös tekintettel a myopathiára. Izomgyengeség, izomfájdalom esetén a kezelés azonnali abbahagyása és a beteg sürgős nefrológiai kontrollja szükséges. Az esetleges myopathia, ill. hepatopathia kizárása céljából a terápia kezdete után 2 héttel a májenzimek, valamint a CK és LDH vizsgálata javasolt.
A kezelés hatásosságának lemérése céljából a terápia kezdete, ill. gyógyszerek adagjának módosítása után 6 hét múlva javasolt a lipidek vizsgálata.
Amennyiben a kontrollvizsgálatok során a lipidszintek továbbra sem érik el a kívánt értéket, felmerül a beteg együttműködésének (diéta, gyógyszerszedés) ellenőrzése, az előbbiekben vázoltak ismételt áttekintése (kiegészítő kezelés, egyéb ok keresése), ill. a lipidcsökkentők adagjának emelése. Az adagemelés során nagy körültekintés szükséges, figyelembe kell venni a fentiekben megadott maximális dózisokat.
Ha a fentiek ellenére sem érik el a zsíranyagcsere paraméterei a kívánt értékeket, a beteg speciális lipidszakrendelésre való irányítása mérlegelendő.
14. táblázat Hazánkban jelenleg forgalomban lévő, gyakrabban alkalmazott sztatinok
| Hatóanyag | Gyári név | Vesekiválasztás (%) | Max. adag,
ha Ccr<20 ml/min |
|---|
| Atorvasztatin | Sortis 10 mg | <2 | 20 mg |
| Fluvasztatin | Lescol 20, 40 mg | 6 | 40 mg |
| Lovasztatin | Mevacor 20, 40 mg | 30 | 20 mg |
| Szimvasztatin | Zocor 10, 20, 40, 80 mg | 13 | 20 mg |
15. táblázat Hazánkban jelenleg forgalomban lévő, gyakrabban alkalmazott fibrátok
| Hatóanyag | Gyári név | Max. adag,
ha Ccr 30-60 ml/min | Max. adag,
ha Ccr<20 ml/min |
|---|
| Bezafibrát | Bezalip 200 mg
Bezalip retard 400 mg | 1x1
másnaponta 1 | másnaponta 1
- |
| Ciprofibrát | Lipanor 100 mg | másnaponta 1 | - |
| Fenofibrát | Lipanthyl 100 mg caps
Lipidil 200 mg caps
Lipidil supra 160 mg MR tbl
Nofibal 250 mg retard tbl | 2x1
másnaponta 1
másnaponta 1
másnaponta 1
| 1x1
-
-
-
|
| Gemfibrozil | Innogem 300 mg caps
Innogem 600 mg tbl
Minilip 600 mg tbl | 2x1
1x1
1x1 | 1x1
-
- |
Antidiabetikus kezelés a vesepótló kezelésben részesülő betegeknél
Bevezetés
A diabéteszes vesepótló kezelésben részesülők a halmozott cardiovascularis kockázat miatt különösen veszélyeztetett populáció. Másrészt az idős, vesepótló kezelést kapók között gyakran alakul ki 2-es típusú diabetes mellitus. Csökken az inzulinszekréció, és szöveti inzulinrezisztencia alakul ki a veseelégtelen, korábban nem diabéteszes betegekben. Mind a máj, mind pedig a vázizomzat inzulinrezisztenciája igazolható. Ugyanakkor az inzulin vesében történő eliminációja és a vese glükoneogenezise elvész, illetve a betegek gyakran étvágytalanok, ezért hajlamosak a hypoglykaemiára is. A vese a fő eliminációs szerve a C-peptidnek is. Ezért veseelégtelen 1-es típusú cukorbetegeknél is lehet a szérumnak közel normális C-peptid-szintje, ami a vesepótló kezelésre kerülő, korábban nem specifikáltak diabéteszének klasszifikációját nehézzé teheti. Nehéz ez azért is, mert az időskori diabéteszesek 5-10%-a késői 1-es típusú cukorbeteg, a 2-es típusú diabetes mellitus tartós fennállása esetén az inzulinszekréciós kapacitás jelentősen beszűkül, és a veseelégtelenség progressziója során a típusosan obes 2-es típusú diabéteszes betegek testsúlya csökken.
Klasszifikációs kritériumok
1-es típusú diabetes mellitus: a diabétesz 25 éves kor alatt kezdődik, ketoacidosissal jár, a diagnózis felállításakor nincs obesitas, a diabéteszt kezdete után egy éven belül inzulinnal kezelik, urémiás állapotban is az éhgyomri C-peptid 0,2, a stimulált érték pedig 0,5 nmol/l alatti.
2-es típusú diabetes mellitus: a diabétesz 40 éves kor fölött kezdődik, ketoacidosissal nem jár, a diagnózis felállításakor obes, a diagnózist követő két éven belül nem szorul inzulinkezelésre, urémiás állapotban az éhgyomri C-peptid általában 0,5 nmol/l fölötti.
Ezeket a kritériumokat használva sem végezhető el minden esetben a klasszifikáció. A nem klasszifikálható betegeknél célszerű inzulinkezelést indítani. Pancreas- vagy pancreas-vese transzplantációs várólistára az 1-es típusúnak diagnosztizált beteg vehető fel.
A szénhidrát-anyagcsere célértékei
A vesepótló kezelésben részesülő cukorbetegek szénhidrátanyagcsere-célértékeit illetően nincs egységes állásfoglalás, de talán elfogadható, hogy a vesepótló kezelésben nem részesülők számára megfogalmazott célok itt is érvényesek: hemoglobin A1c <7%, éhgyomri plazmaglükóz 5,0-7,2 mmol/l. Kapilláris vércukor-önellenőrzés során: éhgyomri érték <6,5 mmol/l, postprandialis érték <9 mmol/l. Az ennél szigorúbb célkitűzés növekvő hypoglykaemiakockázattal járhat.
Diabéteszes vesepótló kezelésben részesülő betegek diétája
Krónikus veseelégtelenségben és diabetes mellitusban az anyagcsere tartós szabályozási zavara lép fel. Az anyagcsere-változások érintik a fehérje-, a zsír-, a szénhidrát- és az ásványianyag-cserét is. Nagyon gyakori a részben diabéteszes, részben urémiás eredetű vegetatív neuropátia, ami gastrointestinalis motilitas- és felszívódási zavarokhoz vezethet.
A fehérje-anyagcsere zavara a fehérjetermészetű toxinok keletkezésének fokozódásával jár együtt. Diabetes mellitusban fokozódik a fehérjetermészetű glikációs végterméknek nevezett toxinok képződése, amelyek eliminációja csökken a veseelégtelenség miatt. Csökken a plazma esszenciális aminosavszintje, ezen belül az elágazó szénláncú aminosavak szintje. A fehérjekatabolizmus egyik fő oka a metabolikus acidózis, melyet diabéteszes betegek esetében tovább ronthat az esetleges diabéteszes ketoacidosis. A fehérje-anyagcsere zavarának másik fontos tényezője a metionin-anyagcsere zavara, melynek következtében a homocisztein szérumszintje megemelkedik, és az atherosclerosis kockázata növekszik. Ennek oka a homocisztein vesén keresztüli csökkent kiválasztása és a diabéteszre jellemző fokozott képződése.
A zsíranyagcsere-zavar kialakulásában mind az urémia, mind a diabétesz szerepet játszik. Mindkét betegség atherogen irányba tolja el a zsíranyagcserét. Csökken a szérum HDL-koleszterin-, nő az LDL-koleszterin- és a trigliceridszintje.
A szénhidrát-anyagcsere változására az inzulinrezisztencia mellett jellemző, hogy nő a contrainsularis hormonok szintje (glükagon, növekedési hormon). A dialíziskezelés bevezetése után a glükóztolerancia javul, de a növekedési hormon szintje továbbra is emelkedett marad.
Az ásványianyag-csere változására jellemző a hyponatraemia, a hypocalcaemia, a hyperkalaemia és a hyperphosphataemia. A vitaminháztartás változását a vízoldékony vitaminok, valamint az aktív D-vitamin hiánya jellemzi.
A diétás kezelés célja
- A szénhidrátháztartás egyensúlyban tartása.
- Az egyes tápanyag-összetevők mennyiségi és minőségi fedezése.
- A malnutritio megakadályozása és megelőzése.
- A szövődmények kialakulásának megakadályozása.
Figyelembe veendő szempontok
- Két dialíziskezelés között minél kevesebb folyadék terhelje a szervezetet.
- Az elfogyasztott táplálék biztosítsa a szervezet számára szükséges energiát.
- Növelni kell a fehérjebevitel mennyiségét.
- Törekedni kell a táplálékkal elfogyasztott kálium és foszfor mennyiségének csökkentésére.
- A szénhidrátbevitel mennyiségi és minőségi meghatározása a vesepótló kezelés fajtája szerint.
Az adekvát diéta feltételei
- A beteg meggyőzése a diéta fontosságáról, a rendszeres gyógyszeres és vesepótló kezelés mellett.
- Egyéni diétás javaslat adása, diétás napló vezetése, ennek időközönkénti ellenőrzése.
- Rendszeres dietétikai tanácsadás.
- Együttműködő orvos-dietetikus kapcsolat a műveseállomáson.
Folyadékbevitel
A napi folyadékbevitel meghatározásánál igen fontos a száraz testsúly meghatározása és elérése. Diabéteszes betegeknél gyakori az ödémaképződés. Ennek kialakulásában szerepet játszhat a magasabb vércukorszint miatti fokozott szomjúságérzés is. A száraz testsúly elérése esetén a beteg normotenziós és ödémamentes. Ezen állapot elérése után a napi folyadékbevitel, a naponta ürített vizeletmennyiség +500-700 ml lehet. Törekedni kell arra, hogy az interdialitikus testsúlynövekedés ne haladja meg a 2-2,5 kg-ot.
Sóbevitel
Urémiás, diabéteszes betegeknél gyakori a szomjúságérzés, melynek kiváltásában az esetlegesen magasabb vércukorszint mellett a sózás a leggyakoribb ok. Fontos a konyhasó bevitelének napi 3-4 g-ra történő korlátozása, amit el lehet érni, ha a beteg kerüli az utánsózást, illetve az ismerten nagy sótartalmú ételek fogyasztását.
Energiaigény
Dializált betegek energiaigénye a korábban említett anyagcsere-folyamatok miatt 35-40 kcal/ttkg kell legyen. 2-es típusú diabéteszes dializáltaknál gyakori az elhízás, ezért náluk az energiabevitelt korlátozni kell, de mindig szem előtt kell tartani, hogy a betegség eme stádiumában ezek a páciensek is hajlamosak lehetnek a malnutritióra. Az optimális energiaigény azt jelenti, hogy a betegnél nem észlelünk katabolizmust, ezt antropometriás vizsgálatokkal ellenőrizhetjük.
Szénhidrátbevitel
Arra kell törekednünk, hogy diabéteszes betegeknél a napi szénhidrátbevitel az összenergia 55-60%-a legyen. A hemodializálóoldat cukortartalma alacsony (2 mmol/l), így hemodialíziskezelés alatt csökken a beteg vércukorszintje, emiatt ajánlatos a betegnek a dialízis ideje alatt étkeznie, legalább 25-30 g szénhidrátot fogyasztania. Általában külön cukoroldat adására nincs szükség.
A CAPD kezelés esetén a peritonealis dializálóoldat különböző töménységben cukrot tartalmaz (1,5; 2,5; 4,25%). A hasüregben lévő oldatból hozzávetőlegesen napi 100 g glükóz szívódik fel, mely 400 kilokalóriát jelent. A folyamatos ambuláns peritonealis dialíziskezelést végző cukorbetegek ennek ellenére folytathatják eddigi diabéteszes diétájukat, kiegészítve az urémia miatti egyéb előírásokkal. A napi szénhidrátbevitelnél a peritoneumon keresztül felszívódó glükózt figyelembe kell venni az étrend összeállításánál. CAPD kezelés mellett a glükózfelszívódás egyenletes, így a vércukorszint ingadozása is kisebb, mint hemodialíziskezelésnél.
Fehérjebevitel
Fontos megértetni a vesepótló kezelésben részesülő beteggel, hogy míg a vesepótló kezelés előtt, a microalbuminuria észlelésétől kezdve csökkentett fehérjetartalmú diétát javasoltunk (0,5-0,7 g/ttkg a stádiumtól függően), addig a vesepótló kezelés alatt az egészséges egyének adagja fölé kell emelni a proteinbevitelt. Ha pedig vese- vagy pancreas-vese transzplantációban részesül, ismét csökkenteni kell a fehérjebevitelt. A fehérjebevitel hemodializált betegeknél átlagos testsúly mellett 1,2 g/ttkg kell legyen. A fehérjék 50%-a állati, 50%-a növényi eredetű összetételben javasolható. Hasűri dialízis esetén (CAPD kezelés) a hasi dializálóoldattal naponta 15-20 g fehérjét veszít a beteg, ezért 1,4 g/ttkg fehérje fogyasztása javasolt.
Zsírbevitel
Urémiás diabéteszes betegeknél a zsírbevitel fontos energiaforrás. Az állati eredetű telített zsírsavakat tartalmazó élelmiszerek energiatartalma magas, de éppen telített zsírsavtartalmuk miatt kedvezőtlenül befolyásolják a szérumlipidszintet. Tekintettel arra, hogy diabéteszes, urémiás betegek esetében a zsíranyagcsere egyértelműen atherogen irányba tolódott el, a beteg telítetlen zsírsavat tartalmazó ételeket fogyasszon.
Kálium- és foszforbevitel
Hemodializált betegek maximum napi 1500-2000 mg káliumot fogyaszthatnak. Dialízisprogramban napi 600 mg/nap foszforbevitel elegendő, mivel gyakori a betegeknél a hyperphosphataemia.
Nyomelembevitel és vitaminpótlás
A nyomelemek közül fontos a vas és a cink pótlása. Ügyelni kell az alumíniumfelhalmozódás jeleire (anémia, neurológiai tünetek). Krónikus veseelégtelen betegek között gyakori a vashiányos állapot, valamint a folsavhiány, ezért célszerű a vas- és folsavpótlás együttes biztosítása. A megfelelő cinkbevitel a B-lymphocyták számának növekedését, az ízérzés javulását és a szexuális diszfunkció csökkenését eredményezheti.
Dializált betegeknél a vízoldékony vitaminok hiánya alakulhat ki, ezért szinte minden dializált beteg vitaminpótlásra szorul. A D-vitamin adása laboratóriumi és klinikai követést igényel (kalcium, foszfor, PTH). A C-vitamin-bevitelt napi 140-200 mg dózisra kell korlátoznunk, mivel nagyobb bevitel oxalátakkumulációt idézhet elő a zsigerekben, lágy részekben, csontokban és erekben. Multivitamin-készítmények közül kerülni kell a bármely vitamint nagy mennyiségben tartalmazó készítményeket, különösen az A-vitamint és a nagy dózisú C-vitamint tartalmazókat. Figyelembe kell venni, hogy a multivitamin-készítmények gyakran nyomelemeket is tartalmaznak, ezek közül a káliumtartalmú készítményeket mellőzni kell.
Diabéteszes vesepótló kezelésben részesülő betegek orális antidiabetikum-kezelése
Orális antidiabetikus kezeléssel a szénhidrát-anyagcserét a következő módokon lehet befolyásolni (csak 2-es típusú cukorbetegeknek javasolt):
- inzulinszekréciót serkentők: szulfanilureák, glinidek;
- inzulinrezisztenciát csökkentők: biguanidok, tiazolidindionok;
- glükózfelszívódást gátlók: α-glükozidáz gátlók.
Ahol nem térünk ki részletekre, ott az adott gyógyszerre leírt szokványos, vesepótló kezelésben nem részesülőknek ajánlott alkalmazás javasolt.
Szulfanilureák
A hazánkban forgalomban lévő készítmények: glibenclamid (Gilemal®, Glibenclamid®, Glucobene®), glipizid (Minidiab®), gliquidon (Glurenorm®), gliclazid (Diaprel®, Gluctam®), glimepirid (Amaryl®).
Annak ellenére, hogy az irodalmi adatok rendkívül ellentmondóak, az ebbe a csoportba tartozó szerek vesén keresztüli kiválasztódásuk szerinti sorba állíthatók (a túlnyomórészt vesében kiválasztódók felől): glipizid > gliclazid > glibenclamid > glimepirid > gliquidon. Sokak álláspontja szerint a szulfanilureák adása kontraindikált veseelégtelenségben (egyes vélemények 180-as, mások 250-es szérumkreatinin-szint esetén tiltanák meg a szulfanilureák adását), mert szerintük akkumulálódnak és súlyos hypoglykaemiát okozhatnak. Ez a merev álláspont változóban van. Számos helyen szövődménymentesen és eredményesen alkalmazzák a gliquidont vesepótló kezelésben részesülők esetében is. Esetleg a tartóshatású glimepirid is adható, de óvatossággal és dózisredukcióval. A gliclazid, a glipizid és a glibenclamid adása nem javasolt dialíziskezelésben részesülő 2-es típusú diabéteszes betegek esetében.
Glinidek
A hazánkban forgalomban lévő készítmények: repaglinid (Novonorm®), nateglinid (Starlix®).
A repaglinid esetében kevés az adat ahhoz, hogy végleges véleményt alkothassunk. Akkumulációt figyeltek meg súlyos veseelégtelenségben, ezért vesepótló kezelésben részesülők esetében csak alacsony dózisban és óvatossággal adható. A nateglinidet szedő dializáltaknál nem találtak akkumulációs tendenciát, ezért vesepótló kezelésben részesülőknek adható. Ezek a gyógyszerek nagyon újak, ezért további tapasztalatok gyűjtése szükséges veseelégtelenek kezelése során.
Biguanidok
A hazánkban forgalomban lévő készítmények: metformin (Adimet®, Maformin®, Meforal®, Merckformin®, Metrivin®), buformin (Adebit®).
Veseelégtelenségben, a laktátacidózis kockázata miatt, le kell állítani ezek adását (férfiaknál 135, nőknél 110 mol/l-es szérumkreatinin esetén), ezért dialíziskezelés során sem adhatók.
Tiazolidindionok
A hazánkban forgalomban lévő készítmény: rosiglitazon (Avandia®).
Hemodializált betegeknél gyakorlatilag változatlan volt a klinikofarmakológiai profilja, de a metabolitjairól kevés információnk van, ezért vesepótló kezelésben részesülőknek egyelőre nem javasolt adni.
α-glükozidáz gátlók
A hazánkban forgalomban lévő készítmény: acarbos (Glucobay®).
Az acarbosnak ugyan csak a 0,4-1,7%-a szívódik fel, de veseelégtelenségben akkumulálódik és májfunkciós eltérést okoz, ezért 25 ml/min alatti GFR esetén nem alkalmazható, így vesepótló kezelésben részesülőknek sem adható.
Diabéteszes vesepótló kezelésben részesülő betegek inzulinkezelése
Hemodialízis és szubkután inzulinadás
Az urémiás diabéteszes betegeknél az inzulin renalis, illetve extrarenalis katabolizmusa csökkent, ezért a keringésben levő inzulin féléletideje megnyúlik. A rövid hatású inzulin intermedierként működik. Ezért a szokásosnál kisebb dózisú inzulin adása javasolt. Egyes ajánlások krónikus veseelégtelenségben 50%-os inzulindózis-csökkentést javasolnak, ha a GFR 10 ml/min alá esik. Mások akut veseelégtelenségben 40-85%-os redukciót hajtottak végre.
Nem áll rendelkezésünkre megfelelő összehasonlító klinikofarmakológiai tanulmány, de előzetes, kis betegpopuláción végzett vizsgálatok arra utalnak, hogy a szubkután adott analóg inzulinok (aspart-, lispro-inzulin) megtartják kedvező farmakológiai profiljukat, gyorsan emelkedik szérumszintjük, és korai eliminációjuk miatt nem okoznak postprandialis hypoglykaemiát.
További figyelmet igényel az, hogy a hemodializáltaknál dialízis- és dialízismentes napok váltakoznak. Egyesek szerint a dialízisnapokon csökkenteni kell az inzulindózist, mások ezzel nem értenek egyet.
Az elmondottakból következik, hogy az inzulinnal kezelt 2-es típusú cukorbetegek egy részénél (hozzávetőlegesen harmaduknál) a hemodialízis megkezdésekor az inzulin elhagyható, és orális antidiabetikumra (pl. gliquidonra) lehet áttérni.
A korábban inzulinra nem szoruló diabéteszes betegek egy részénél (hozzávetőlegesen ötödüknél) a hemodialízis megkezdése után inzulinkezelést kell elindítani.
A hemodialíziskezelésben részesülő betegeknél gyakran az intenzív-konzervatív (bolusz-bazális) inzulinkezelést alkalmazzuk, törekedve a kis dózisú, rövid hatású inzulinadagokra a hypoglykaemiahajlam miatt. Ez a kezelés reggeli, ebéd és vacsora előtt adott rövid hatású (ún. bolusz) inzulin és lefekvéskor elhúzódó, általában NPH típusú inzulin adását jelenti. Minden esetben javasolt a vércukor-önellenőrzés végzése.
Peritonealis dialízis és szubkután vagy intraperitonealis inzulinadás
A peritonealis dialízissel kezelt diabéteszesek inzulinterápiáját illetően egymásnak ellentmondó vélemények ütköznek. Egyesek kifejezetten a szubkután, mások pedig az intraperitonealis inzulin adását preferálják. Jelenleg négy, kisszámú betegen végzett összehasonlító tanulmány áll rendelkezésünkre. Közülük három az intraperitonealis adagolást találta kedvezőbbnek a szénhidrát-anyagcsere szempontjából, de kettőjük szerint az intraperitonealis inzulinadás kedvezőtlen volt a zsíranyagcserére, a negyedik nem talált különbséget a kétfajta adagolási mód között.
A cardiovascularis mortalitás szempontjából nem értékelték az eredményeket. Az intraperitonealis inzulinkezelés kapcsán leírták a hepaticus subcapsularis steatosist, de jelenleg nem ismert ennek sem előfordulása, sem jelentősége. Az intraperitonealis inzulinkezelés lehetséges előnye a szisztémás hyperinsulinaemia megelőzése a májban bekövetkező first-pass hatás miatt és a kisebb vércukor-ingadozás.
A peritonealis dialíziskezelésben részesülő betegeknél általában a dialízisoldathoz adott rövid hatású inzulinkészítményekkel (Insulin Actrapid®, Humulin R®) érhetők el az optimális vércukorértékek, bár néhányan az üres peritoneuműrbe adott inzulinkezelés mellett foglalnak állást. Az analóg inzulinokról (lispro-, aspart-inzulin) nincs adat. A beadáshoz javasolt a viszonylag hosszú, 3-8 cm-es tűk használata, hogy az inzulin teljes dózisa bekerüljön a dialízisoldatba. Az inzulin beadását követően a dialízisoldatot tartalmazó zsákot többször meg kell forgatni az inzulin homogén megoszlása érdekében. A CAPD kezelésben részesülő betegeknél az intraperitonealisan adott napi inzulindózis általában a szubkután adott teljes dózis (rövid + intermedier vagy hosszú hatású inzulin) 2-3-szorosának felel meg, ugyanis az inzulin 10-20%-a kicsapódik a műanyag felszínekre, és csak 40%-a szívódik fel a peritoneuműrből. Ha az üres peritoneuműrbe adjuk, akkor 15-45, ha a dializálóoldatba, akkor 90-120 perc múlva éri el a széruminzulinszint a maximumát.
A CAPD kezelésben részesülő betegeknél az intraperitonealis inzulin adására vonatkozó néhány szabály: A napi 4x2 liter dialízisoldat cseréje közül az első három 20 perccel a főétkezések előtt történik, míg a negyedik éjjel 11 órakor. A vércukorszintet a három főétkezés előtt és után, valamint lefekvés előtt ellenőrizzük, Somogyi-effektus gyanúja esetén éjjel 3 órakor is szükséges mérni. Az intraperitonealis inzulinkezelés első napján mindegyik 2 literes dialízisoldatot tartalmazó zsákba a szubkután napi inzulinadag (rövid + intermedier vagy hosszú hatású inzulin) negyedét és még a dializálóoldat glükózkoncentrációjától függően az alábbi plusz inzulinmennyiséget tegyük: 1,5%-os dextrózzsákhoz +2 E-et, 2,5%-os dextrózzsákhoz +4 E-et, 4,25%-os dextrózzsákhoz +6 E-et. A vércukor-ellenőrzés eredményei alapján kell változtatni az inzulinadagokat a korábban jelzett célértékek eléréséig.
Pancreas-vese transzplantáció
A pancreas-vese transzplantált 1-es típusú diabéteszes, urémiás betegek mortalitási kockázata jelentősen alacsonyabb, mint az 1-es típusú diabéteszes, urémiás vesetranszplantáltaké.
A pancreas-vese transzplantáltak életminősége is jobban javul, mint a vesetranszplantáltaké, mert inzulinadás- és dialízismentessé is válnak.
A pancreas és a vese egyidejű transzplantációja kivédi a diabetes mellitus akut szövődményeit (ritkán enyhe hypoglykaemia jelentkezhet a pancreas-vese transzplantáció után, hyperglykaemia jól működő graft mellett nincs), lelassítja a transzplantált vesében a diabéteszes nephropathia visszatérésének ütemét, a retinopathia progresszióját, különösen akkor, ha korai retinopathia állt fenn a transzplantáció előtt. Jobban javul pancreas-vese transzplantáltaknál a neuropátia és talán az erectilis dysfunctio is, mint a csak vesetranszplantált 1-es típusú diabéteszeseknél.
A perifériás macrovascularis és a coronariaszövődmény nem javul a pancreas-vese transzplantáció után. Mindezek alapján a pancreas-vese transzplantáció az elsőként választható kezelési módok közé tartozik a veseelégtelen, 1-es típusú diabéteszes betegek esetében. Az első pancreastranszplantáció, 1966 óta közel 14 000 pancreastranszplantációt végeztek, tehát ma már nem tartozik a ritka kezelési módok közé. Az 1 éves graft túlélés 80-90%-os a pancreas és 90%-os a vese szempontjából.
Transzplantáció előtti kivizsgálás
Laboratóriumi vizsgálatok
- Általános vizsgálatok: vérkép, protrombin, parciális tromboplasztinidő, hemokultúra.
- Vesevizsgálatok: karbamidnitrogén, kreatinin, kreatinin clearance, proteinuria, vizeletüledék.
- Anyagcsere-endokrin vizsgálatok: amiláz, lipáz, hemoglobin A1c, éhgyomri glükóz, éhgyomri és postprandialis C-peptid, koleszterin, triglicerid, HDL-koleszterin, parathormon.
- Szerológiai vizsgálatok: vércsoport (ha nem lenne ismert), HLA-tipizálás, VDRL, vírusszerológia: EBV, HIV, HBV, HCV, CMV.
Cardiovascularis vizsgálatok
- EKG, echokardiográfia, ergometria, kardiológiai konzílium, szükség esetén koronarográfia, cardiovascularis autonóm neuropátiateszt, perifériás erek állapota (alsó végtagi és carotis Doppler-ultrahang).
Pancreas-vese transzplantáció előtti cardiovascularis kivizsgálás
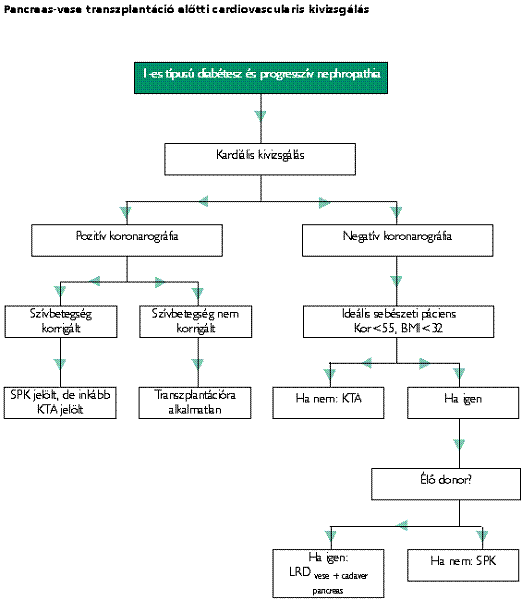
KTA = vesetranszplantáció
SPK = szimultán pancreas-vese transzplantáció
LRD = élő, rokondonor
Egyéb vizsgálatok és konzíliumok
Mellkasröntgen, hasi ultrahang, nők esetében - 35 év felett - mammográfia, nőgyógyászati vizsgálat (citológia is), fogászati vizsgálat, nefrológus, diabetológus, transzplantációs sebész által felvett teljes anamnézis és fizikális vizsgálat, szemészeti vizsgálat (fundus is).
Kombinált pancreas-vese transzplantációs várólistára való felkerülés kritériumai
A betegnél az alábbi feltételek egyike álljon fenn:
- vagy 1-es típusú diabetes mellitus* és vesepótló kezelés szükségessége (* a diabétesz klasszifikációját lásd fent);
- vagy 1-es típusú diabetes mellitus és vesekárosodás (kreatinin clearance 50 ml/min alatti).
További feltételek
A betegnél ne álljon fenn a szervátültetés ellenjavallatainak egyike sem. A beteg a tervezett műtéthez járuljon hozzá. A kora <55 év, testtömegindexe <32 kg/m2 legyen.
Speciális bevételi kritériumok
Pancreastranszplantáció vesetranszplantáció után (PAK):
- stabil vesetranszplantáció utáni vesefunkció (GFR>40 ml/min cyclosporin A-kezelés mellett);
- vagy pancreas-vese transzplantációt követő pancreasgraft bármilyen okból történő eltávolítása után;
- és progrediáló diabéteszes szövődmények (retino-, neuro- vagy vasculopathia);
- vagy hiperlabilis diabétesz életminőség-romlással.
Kizárási kritériumok:
- nem korrigálható súlyos coronariabetegség vagy alacsony ejekciós frakció (<50%);
- kábítószer- és alkoholabúzus;
- jelentős pszichiátriai betegség;
- aktív infekció vagy tumoros betegség;
- cerebrális insufficientia.
A műtétre történő beválasztás szabályzata
Kombinált pancreas-vese transzplantációra a várakozólistán első helyen álló beteget kell kiválasztani.
Feltéve, hogy:
- a beteg a donoréval azonos fő vércsoportú;
- a műtét idején nem áll fenn a műtét egyetlen ellenjavallata sem;
- a beteg a műtétbe beleegyezik;
- a beteg a tervezett műtétről értesíthető és a műtét helyére beszállítható (pl. nem tartózkodik külföldön).
Kombinált pancreas-vese átültetési várólistán a betegek sorrendjét a listára kerülés időpontja határozza meg. Ha a várakozólistán első helyen álló betegnél a műtét nem végezhető el, akkor a listán az elsőhöz legközelebb állót kell kiválasztani. Ha a várakozólistán nem szerepel a donoréval megegyező fő vércsoportú beteg, akkor a várólistán az elsőhöz legközelebbi helyen álló, a donor fő vércsoportjával kompatibilis vércsoportú beteget kell műtétre kiválasztani. Ha a várakozólistán első helyen szereplő beteg bármilyen ok miatt nem műthető, helyét a listán megtartja.





