Az akut coronariaszindróma ST-elevációval nem járó formáinak diagnosztikája és kezelése
• Kardiológiai Szakmai Kollégium •
2003
Írták: Keltai Mátyás (munkacsoport-vezető), Bodor Elek, Jánosi András, Kiss Róbert Gábor, Molnár Ferenc
Bevezető
Az akut coronariaszindróma (ACS) diagnosztikája és kezelése az elmúlt években rendkívül intenzív változáson ment keresztül, a kezelési elvek szinte évente változtak annak megfelelően, hogy ismertté váltak a kérdéssel foglalkozó nagy esetszámú, randomizált tanulmányok eredményei. A szakmai kollégium állásfoglalását előkészítő munkacsoport a 2002 decemberéig publikált anyagokat vette figyelembe, különös tekintettel támaszkodott az Európai Kardiológustársaság és az Amerikai Kardiológustársaság legújabb ajánlásaira (1, 2).
Az evidenciaszinteket és az ajánlási osztályokat illetően a nemzetközi szakirodalomban elfogadott kritériumokat és besorolást alkalmaztuk.
Definíció
Akut coronariaszindróma (ACS)
Akut coronariaszindróma néven foglaljuk össze az instabil angina pectorist, a kialakulóban lévő és a definitív szívizomelhalást. Megkülönböztetünk ST-elevációval járó ACS-t (STEMI), ill. ST-elevációval nem járó (NSTEMI) heveny coronariaszindrómát. Ez az ajánlás a nem ST-elevációs (NSTEMI) ACS diagnózisával és kezelésével foglalkozik.
Patofiziológia
A folyamat patofiziológiai lényegét a szívizom oxigénigénye és a kínálat közötti diszkrepancia képezi. Az esetek többségében az ischaemia oka elsődlegesen a koszorúér-keringés elégtelensége (oxigénhiány), míg más esetekben az oxigénigény növekedése.
- A koszorúér-keringés zavarát idézheti elő a koszorúér jelentős szűkülete, ill. olyan állapot, amikor a nem jelentős szűkülethez plakkruptura és/vagy thrombus társul.
- Dinamikus coronariaobstrukció (spazmus) ugyancsak a koszorúér-keringés jelentős zavarát idézheti elő.
- Az artériafalban (atheroscleroticus plakkban) zajló gyulladásos folyamatok, ill. az ezzel kapcsolatban fellépő protrombotikus tényezők kritikus keringéscsökkenést, ill. teljes okklúziót idézhetnek elő.
A felsorolt tényezők esetén primer instabil állapotról beszélünk, míg szekunder instabil állapotról azon esetekben, amikor az ischaemia hátterében valamilyen más kórfolyamat áll, így pl. az oxigénigény tartós növekedését láz, tachyarrhythmia, hyperthyreosis, anémia okozza, ill. a koszorúér-áramlás hipotónia miatt elégtelen.
Az instabil plakk
Az instabil, rupturára hajlamos plakk az esetek több mint felében a ruptura bekövetkezte előtt nem okoz szignifikáns stenosist a koszorúérben. A nem kollaterizált, korábban ischaemiát nem okozó coronariakeringés hirtelen megszűnése súlyosabb következményekkel jár, mint az ischaemiás prekondicionálást követő coronariaokklúzió. A plakk rupturált felszínének passzivációja után az áramlászavar az esetek jelentős részében javul, a klinikai állapot stabilizálódik.
Az instabil plakk kórtani jellemzői: kiterjedt, lágy, koleszterindús lipidmag; a simaizomelemek relatíve alacsony száma; a vékonyabb, sérülékeny „sapka”; a zajló lokális gyulladás, mely a monocyta-makrofág elemek, neutrofil granulocyták, T-lymphocyták és mastocyták fokozott infiltrációja képében jelentkezik. A fehérvérsejtek behatolását az adhéziós molekulák expressziója segíti.
A plakkdisruptio különféle megjelenési formái: aktív, passzív ruptura és a plakkerózió. A plakkerózió esetében a plakk nem ürül ki, és belsejében nem találunk thrombust, szemben az előző két formával. Az, hogy a plakk mennyire sérülékeny, részben a körkörös falfeszüléstől, részben a plakk lipidtartalmának nagyságától, összetételétől és elhelyezkedésétől függ. Különösen nőknél, hipertóniásoknál és cukorbetegeknél gyakori a plakkerózió. Erodált plakk esetén a thrombus a plakk felszínéhez tapad, míg plakkruptura esetén a thrombus a mélyebben fekvő lipidmaggal érintkezik. A plakk fibroticus bevonatát kollagéntartalmú szövet alkotja. Ezt a tokot az apoptosis, a makrofáginfiltráció, a T-lymphocytákból származó citokinek és a simaizomsejtekből származó metalloproteázok gyengítik. Ha a vér érintkezésbe kerül a plakk belsejében lévő rendkívül trombogén lipidmaggal, annak felületén thrombocytadús thrombus formálódik. A vérrög által okozott áramlászavar lesz az, amelynek klinikai következményei szerint instabil angina vagy myocardialis infarktus következik be. Hogy a kialakuló thrombus mennyire lesz occlusiv és permanens, azt a protrombotikus-antitrombotikus folyamatok egyensúlya szabja meg. A részben vagy teljesen occlusiv thrombus - sajátos periodicitást mutatva - összezsugorodik, gömb alakot vesz fel, majd a coronaria distalis részébe embolizál. Ilyenkor a beteg panasza megszűnik, mindaddig, amíg újabb áramlászavart okozó thrombus nem képződik. Jórészt ez a ciklikus áramlásredukció áll az instabil anginás beteg nyugalmi, visszatérő, nitroglicerinre alig reagáló anginái hátterében. Az embolisatiót és így indirekt módon a plakkrupturát a biokémiai markerek (troponin T vagy I) megjelenésével tudjuk regisztrálni.
A vasoconstrictio fontos faktora lehet az ACS-nek, részben primeren (lásd Prinzmetal angina), részben pedig a plakkrupturától distalis coronariaszakaszon, ahol az aktivált thrombocytákból felszabaduló tromboxán A2 és szerotonin okoz spazmust, tovább rontva a keringést.
A plakkruptura gyógyulásának természetes lefolyása
A tartós és végleges okklúzió során az eret szervült thrombus zárja el. A komplett okklúzió esetén is az esetek mintegy felében néhány nap múlva spontán rekanalizáció következik be, a plakkruptura felszínén szervült thrombus figyelhető meg, majd a laesiót benövi az endothel. Indirekt bizonyítékaink vannak arra, hogy a ruptura felszíne csak relatíve lassan, 6-8 hét alatt veszíti el trombogén tulajdonságát.
A nekrózis folyamata és az ischaemia reverzibilitása
Myocardiumnecrosishoz két mechanizmus vezethet:
- A plakkrupturán növő és embolizáló thrombus darabjai a coronariák kis arterioláit tömik el, és így fokális micronecrosisok képződnek akkor is, ha a plakkrupturán növő thrombus lényeges áramlászavart nem okozott. A jelenséget a troponinpozitivitással detektálni tudjuk, ami bizonyítja, hogy valóban zajló myocardialis micronecrosissal („minimal myocardial damage”) állunk szemben.
- A rupturált plakk felszínén növő thrombus a vér áramlását átmenetileg vagy tartósan elzárja. Ilyenkor, ha nincsenek megfelelő kollaterálisok, mintegy 20 percen túli okklúzió esetén elkezdődik a szívizomsejtek elhalása. Egy epicardialis nagy coronariaág okklúziója esetén az érhez tartozó ellátási területen az endocardium felől az epicardium felé keskenyedő ék alakot formáló területen indul meg a nekrózis. A subendocardialis myocardiumréteg a legsérülékenyebb, mert - noha oxigénfelhasználása relatíve a legnagyobb - vérellátása anatómiai okokból relatíve rosszabb. A nekrózis zónáját mechanikus funkcióját ugyan elvesztő, de irreverzíbilisen nem károsodott sejtek veszik körül (stunned myocardium). A 4-6 órán túli elzáródás esetén az elzárt artéria által ellátott területen kialakul a nekrózis, ettől kezdve a reverzibilitás esélye csekély. A teljes okklúzió esetén rendelkezésre álló időablak 4, maximum 6 órát enged meg a hatékony rekanalizációs beavatkozások számára. Fontos tudni, hogy a reperfúzió során megmentett myocardium jórészt a stunned zónába esik, e szívizomrész mechanikus funkciójára csak napok-hetek múlva számíthatunk.
Akut coronariaszindróma diagnosztikája
Anamnézis
A myocardiumischaemia okozta mellkasi fájdalom számos jellegzetességgel bír, amelynek részletes ismertetése a Stabil angina pectoris szakmai ajánlásban található. A jellegzetességek alapján megkülönböztetünk típusos angina pectorist, atípusos angina pectorist és nem ischaemiás mellkasi fájdalmat. Instabil angina pectorisra utal a nyugalmi, tartós mellkasi fájdalom, az új keletű típusos mellkasi fájdalom („de novo” angina pectoris), valamint a korábban enyhe effort angina súlyossá válása. Általánosságban az instabilitás jelének tartjuk, ha a korábbi panaszok jellegében, erősségében, a megszűnés módjában kedvezőtlen irányú változás következik be. Hasonlóan az egyéb kórformákhoz (stabil angina pectoris, myocardialis infarktus) nem ritka az sem, hogy a panaszok atípusos megjelenésűek, amely főleg idős egyéneken, nőknél, ill. diabéteszben gyakori. Az atípusos panaszok közül kiemelendő az epigastrialis fájdalom/diszkomfort, a lényeges előzmény nélkül fellépő dyspnoe, ill. heveny balszívfél-elégtelenség.
Fizikális vizsgálat
Bár az instabil coronariaszindrómának nincs jellegzetes fizikális lelete, ennek ellenére ebben a kórállapotban is gondosan elvégzendő a fizikális vizsgálat. Adatokat szolgáltathat egyéb betegségek felismeréséhez (pl. strukturális szívbetegség, pericarditis, pneumónia stb.), ill. támpontot adhat a panaszok súlyosbodásáért felelős egyéb eltérések fennállásához (pl. gravis anémia, nem kontrollált hipertónia stb.).
EKG
Az EKG-vizsgálat (12 elvezetéses felvétel) az egyik legfontosabb segítség a kórisme felállításában. A panaszmentes időszakban készített felvétel elsősorban a korábbi időszakban lezajlott myocardialis infarktus (patológiás Q-hullám) felismerését segíti. Az ACS diagnózisát a panasz alatt változó EKG szinte bizonyossá teszi: két összetartozó elvezetésben észlelt ST-depresszió (≥1 mm), ill. T-hullám-negativitás (≥1 mm) a panaszok ischaemiás eredetét bizonyítják. A mellkasi fájdalom kapcsán a mellkasi elvezetésekben észlelt mély, szimmetrikus negatív T-hullám kritikus anterior descendens szűkület egyik jele lehet. Esetenként a panasz megszűnésével az EKG-változás nem regrediál. A mellkasi fájdalom esetén észlelt ST-eleváció a transmuralis ischaemia jele (pl. Prinzmetal angina pectoris, myocardialis infarktus). A mellkasi fájdalom az esetek egy részében nem jár EKG-változással, ilyenkor a panaszok extracardialis okának (pl. gastrooesophagealis reflux, ulcus stb.) tisztázása különösen célszerű. Ischaemiás eredet szabályos EKG esetén sem zárható ki. A mellkasi fájdalom nélkül észlelt EKG-változás hátterében egyéb kórfolyamat is állhat (pl. stroke esetén észlelt aspecifikus ST-T hullámváltozások). ACS-ben vagy annak gyanúja esetén az ST-szakasz többcsatornás, folyamatos monitorozása hasznos eljárás.
Laboratóriumi diagnosztika
Laboratóriumi módszerekkel az egyidejűleg fennálló gyulladás, a rizikófaktorokban levő eltérés megerősítheti a koszorúér-betegség fennállásának gyanúját. A laboratóriumi vizsgálat hasznos a szekunder ACS diagnózisának felállításában (pl. jelentős anémia kimutatása). A tartósan fennálló ischaemia szöveti nekrózist okoz, ami biokémiai módszerekkel kimutatható.
A szívizomelhalás biokémiai jellemzői
Troponin: háromfajta strukturális fehérje (troponin I, T), amely a szívizom myofilamentumaiban helyezkedik el, és a kalcium által regulált aktin-miozin kontrakcióban vesz részt. A szívizomban lévő troponinoknak a vázizomzatban lévő troponinoktól eltérő az aminosavszekvenciája, ezért a troponin I és T szérumszintjének emelkedése szívizom-károsodásra utal. Az Európai és az Amerikai Kardiológustársaság együttes állásfoglalása szerint azt a klinikai képet, mely myocardialis ischaemiával kapcsolatos (mellkasi fájdalom, ST-eltérés) troponinszint-emelkedést mutat, myocardialis infarktusnak kell nevezni (3). A troponinszint emelkedése 3-4 órával a sejtnekrózis után kimutatható, és 7-14 napig észlelhető. Egyetlen troponinmeghatározás a klinikai döntéshez általában nem elégséges. A myocardiumsérülés kimutatásához a mellkasi fájdalom keletkezése után 6-12 órával ismételt biomarkermeghatározás szükséges. Abban az esetben, ha a mellkasi fájdalom az utolsó troponinmeghatározás előtt több mint 12 órával korában történt, akkor a második troponinmeghatározás elhagyható. Troponinpozitivitás előfordulhat egyéb myocardiumsérülést okozó állapotokban (myocarditis, szívelégtelenség, tüdőembólia, cardiotoxicus kemoterápia), és tévesen pozitív eredményt kaphatunk harántcsíkolt izombetegségekben és krónikus veseelégtelenségben is. A betegágy mellett végezhető gyorstesztek kevésbé pontosak, mint a kémiai laboratóriumi meghatározások, akkor ajánlhatók, ha a laboratóriumi meghatározás 60 percen belül nem történhet meg.
Mioglobin: a vázizomzatban és a szívizomban előforduló alacsony molekulasúlyú protein. A myocardiumnecrosist követő igen rövid időn belül (2 óra) már észlehető emelkedett szérumszintje, hátránya azonban, hogy lényegesen kevésbé szívspecifikus, mint a troponin, a kóros szérumszint igen hamar normalizálódik (24 óra). Ez a sorozatban végzett meghatározások értékelését megnehezíti. A mioglobinvizsgálat negatív eredménye alkalmas a szívizomelhalás kizárására 4-8 órával a fájdalmat követően.
Kreatin-kináz (CK-MB izoenzim): a troponinnál kevésbé érzékeny és kevésbé specifikus vizsgálat. A szívizomelhalást követően (6-8 óra után) válik pozitívvá, 3-4 nap után az érték normalizálódik, így a sorozatban végzett meghatározás lehetővé teszi a szívizomnekrózis esetleges késői kiterjedésének megítélését. Az ajánlások az ACS diagnosztikájára csak a CK-MB meghatározást ajánlják, az össz CK- és egyéb enzimaktivitási méréséket nem.
Ajánlások az ACS diagnosztikájára
- Nyugalmi EKG-t kell készíteni, valamint hasznos a többcsatornás, folyamatos ST-szakasz-monitorozás (ennek hiányában naponta több alkalommal - különösen panasz esetén - 12 elvezetéses EKG-regisztrátumot készítünk).
- Troponin T vagy troponin I mérése szükséges felvételkor, és amennyiben normális, akkor a biomarkervizsgálatot (troponin I, T vagy CK-MB izoenzim) meg kell ismételni 6-12 órával később.
- Mioglobinmeghatározás végezhető 6 óránál korábbi tünetekkel jelentkező betegek esetén, mert ez a szívinfarktus korai jele. Végezhető olyan betegeknél is, akiknél két héten belüli infarktust követően visszatérő ischaemia jelentkezett.
Az ajánlás mindhárom pontja A szintű evidencián alapszik. |
|---|
A betegek diagnosztikája az ACS kezdeti fázisában a fentieken alapul. A közvetlen és későbbi prognózismegítélésre további vizsgálatok, így echokardiográfia, terheléses EKG, dobutaminterheléses echokardiográfia, nukleárkardiológiai vizsgálatok (myocardiumszcintigráfia, terheléses myocardiumszcintigráfia stb.) szükségesek. Ezek ismertetése meghaladja a jelen ajánlás kereteit. Utalunk a terheléses kardiológiai vizsgálómódszerek c. ajánlásra.
Tennivalók az ACS tüneteivel jelentkező betegek ellátásában
Az instabil coronariaszindrómával vagy annak gyanújával jelentkező beteget hospitalizálni kell.
Prehospitális ellátás
A helyszíni ellátásban
- elsődleges a fájdalom csillapítása (sublingualis nitrát, eredménytelenség esetén intravénás, kis adagban, frakcionáltan adott morfin);
- aszpirin;
- véna biztosítása;
- keringési állapot megítélése és a paraméterek rögzítése, ill. rendezése (pulzus, vérnyomás: RRsyst = 110 Hgmm, fr: 60/perc);
- EKG készítése (amennyiben elkészítésének feltételei adottak). Az EKG elkészítése nem okozhat késedelmet a beteg további ellátásában. Tilos a beteget EKG-vizsgálatra más intézetbe küldeni!
A beteg szállításának módját a fájdalom súlyossága, ill. a keringési status határozza meg. Stabil állapotú beteg szállítása sürgős, de nem igényel orvosi felügyeletet. Az instabil állapotú betegek szállítása beavatkozásra képes személy folyamatos jelenlétét igényli.
A kórházi ellátás sürgőssége megegyezik a súlyos traumával, vérzéssel stb. hospitalizált betegekével. A beteg érkezhet
- felvételi osztályra;
- általános intenzív osztályra;
- coronariaőrzőbe.
A betegek ellátásának optimális helyszíne a kardiológiai osztály részét képező coronariaőrző.
A coronariaőrzőben a beteget ágynyugalomba helyezzük, folyamatos EKG pulzus- és vérnyomás-monitorozást végzünk. Az ST-szakasz speciális monitorozása rendkívül hasznos, ennek hiányában panasz esetén rögtön, egyébként naponta többször 12 elvezetéses EKG-felvételt készítünk. A beteg prognózisának megítélése a további teendők megítélése végett rendkívül fontos. A prognosztikai szempontból fontos tényezők közül megkülönböztetünk rövid és hosszú távú markereket.
| Ajánlás a kockázatmegítélésre A kockázatmegítélésnek pontosnak, megbízhatónak és - lehetőség szerint - könnyen, gyorsan, olcsón kivitelezhetőnek kell lennie. A prognózis megítélésekor az alábbi tényezők figyelembevétele javasolt. - Az akut (trombotikus) kockázat szempontjából fontos tényezők:
- visszatérő mellkasi fájdalom;
- ST-depresszió;
- ST-szakasz-változás;
- emelkedett troponinszint;
- koronarográfiával igazolt thrombus.
- A hosszú távú kockázat szempontjából fontos tényezők:
Klinikai adatok- életkor;
- anamnézisben infarktus, bypassműtét, diabetes mellitus, szívelégtelenség, hipertónia.
Biológiai markerek- veseelégtelenség (emelkedett szérumkreatinin vagy csökkent kreatininclearance);
- gyulladásos markerek, CRP1-, fibrinogén-, IL-62-emelkedés.
Angiográfiás adatok- balkamra-diszfunkció;
- a coronariabetegség kiterjedtsége.
Az evidencia szintje minden marker esetén: A1CRP = C-reaktív protein
2IL-6 = interleukin-6 |
|---|
A kezelésre vonatkozó ajánlások ACS-ben
A kezelési ajánlásokat öt kategóriában tárgyaljuk:
- Antiischaemiás szerek
- Antitrombin szerek
- Thrombocytaaggregációt gátló szerek
- Fibrinolitikumok
- Antilipaemiás kezelés
- Revascularisatio
Antiischaemiás kezelés
Béta-receptor blokkoló kezelés
Akut coronariaszindrómában a béta-receptor blokkolókat a kezelés megkezdésekor alkalmazzuk, egy időben az aszpirinnel és a rövid hatású nitrátkészítménnyel, ha kontraindikáció nincs. A béta-blokkolók előnyös hatását elsősorban a tartós hatású, intrinszik sympathomimeticus hatással nem rendelkező készítmények esetén bizonyították. Több kisebb - instabil coronariaszindrómában végzett - vizsgálat adata szerint a béta-blokkoló terápia a szívizomelhalás relatív kockázatát 13%-kal csökkentette. A coronariaőrzőben - különösen a kezelés elkezdésekor - a béta-blokkolót intravénásan adjuk olyan adagban, hogy a nyugalmi szívfrekvencia percenként 60 körül legyen.
Nitrátkezelés
A nitrátok alkalmazása igen hatékony tüneti kezelést biztosít ACS-ben.
A nitrátok kedvező hatása a direkt vasodilatatiós hatással, ill. a thrombocytaaggregációt gátló tulajdonságukkal magyarázható. Az ACS-ben elsősorban az intravénás alkalmazási mód jön szóba 12-24 órán keresztül vagy az állapot stabilizálódásáig. A nitrátkezelés hatékonysága az életkilátások kedvező irányú befolyásolása szempontjából nem igazolt.
Káliumcsatorna-aktivátorok
Új gyógyszercsoport, melynek egyik tagjával, a nicorandillal stabil anginában jó eredményeket mutattak ki. ACS-ben egyelőre nincsenek meggyőző bizonyítékok a kezelés hatékonyságáról.
Kalciumcsatorna-blokkoló kezelés
A kalciumcsatorna-blokkoló gyógyszerek csoportjába eltérő járulékos tulajdonsággal bíró gyógyszerek tartoznak. Közös tulajdonságuk, hogy vasodilatatiót, a perifériás és a coronariarezisztencia csökkenését eredményezik. A különböző kalciumantagonisták eltérően hatnak a balkamra-funkcióra és az ingerképző, ingervezető rendszerre. Alkalmazásuktól rövid távon tüneti javulás várható, a hosszú távú adatok hiányoznak. A rövid hatású dihidropiridin készítmények (nagy adagban, tartós kezelés esetén - egyes metaanalízisek eredménye alapján) a cardiovascularis halálozást növelték. Dihidropiridin típusú Ca-csatorna-blokkolók alkalmazását ACS-ben csak béta-receptor blokkolók adása mellett lehet javasolni. Egyéb típusú Ca-csatorna-bénító adása béta-receptor blokkoló ellenjavallata esetén jön szóba.
Antitrombotikus kezelés
Trombingátló szerek
A trombinnak kulcsszerepe van az alvadási cascade-ban. Antitrombin szerként a nem frakcionált nátriumheparint, az alacsony molekulasúlyú heparinokat, a direkt antitrombinokat használhatjuk. Egyéb (Ca-heparin) készítmények alkalmazását nem ajánljuk.
A heparin különböző lánchosszúságú glycosaminoglycan-láncok elegye. Önmagában alig bír antikoaguláns hatással. Ha azonban a heparin az antitrombin-III-hoz (AT-III) kötődik, az AT-III + heparin komplex antikoaguláns hatása a heparinhoz képest ezerszeresére növekszik. A standard klinikai gyakorlatban általánosan elfogadott a heparinkezelés.
Az alacsony molekulatömegű heparinok (LMWH) kisebb molekulatömegűek, mint a nem frakcionált heparinok, mivel rövidebb glycosaminoglycan-láncokból állnak. Nem csupán a trombint, hanem a thrombocyták által termelt Xa-faktor hatását is gátolják. Hatásuk tartósabb, ezért szubkután injekció formájában (naponta kétszer, a beteg testsúlyától függő adagban) adhatók. Egyes klinikai vizsgálatokban az alacsony molekulatömegű heparinok egyes fajtáiról kimutatták, hogy hatékonyságuk a Na-heparinnal egyező vagy annál jobb. Nem igényelnek folyamatos infúziós adagolást és laboratóriumi ellenőrzést.
A hirudin direkt antitrombin. A direkt trombininhibitorok hatékonyabbak a frakcionálatlan heparinnál. A hirudin a kezelés tartama alatt kb. 20-25%-kal képes csökkenteni az ischaemiás események és a revascularisatio gyakoriságát a frakcionálatlan heparinhoz képest. A hirudin alkalmazása esetén azonban a vérzéses szövődmények gyakoribbak, mint heparin adásakor. Kérdés, hogy hatékonyabbak-e a hirudinok a LMWH-knál is. További vizsgálatok szükségesek annak eldöntésére is, hogy a direkt trombininhibitorok kombinációja a leghatékonyabb thrombocytagátlókkal, a fibrinogénreceptor-blokkolókkal eredményez-e további javulást a kezelésben. Kutatási stádiumban van a pentaszacharidok és az orálisan adható melagatran klinikai használhatósága.
Thrombocytaaggregációt gátló szerek (TAGG)
Érfalsérülés esetén a thrombocyták receptoraik révén érintkezésbe kerülnek a szöveti kollagénnel, a von Willebrand-faktorral és a fibrinogénnel. Ezek hatására a thrombocyták kitapadnak. A kitapadt thrombocyták különböző mediátorok révén aktiválódnak. Az aktivált thrombocyták alakváltozáson mennek át, így nagyobb - az alvadás szempontjából aktív - felületet képeznek, és secretoros tevékenységük révén további trombinképződést, thrombocytaakkumulációt és vasospasmust okoznak. Az aktiváció hatására a thrombocyta felszínén levő inaktív GP IIb/IIIa receptorok (sejtenként 40 000-80 000 receptor) szerkezetileg átalakulva ligandkötésre alkalmas állapotba kerülnek. A von Willebrand-faktorhoz való kötődés erősíti a kialakulóban levő thrombus kötődését a sérülés helyéhez, a fibrinogénmolekulák pedig keresztkötéseket hoznak létre a thrombocyták között. Így alakul ki a thrombocytagazdag thrombus, mely ACS esetében patológiailag kimutatható. A thrombocyták újabban megismert kulcsszerepe miatt az ACS antitrombin-kezelésében a thrombocytaaggregációt gátlók szerepe kiemelkedő jelentőségű.
Az alapgyógyszer az aszpirin, mely a ciklooxigenáz bénítása révén gyorsan és tartósan gátolja a vérlemezkék aggregációját. A betegek 10-15%-a azonban allergia vagy intolerancia miatt nem tudja szedni, és további 10-15%-ban aszpirinkezelés ellenére sem alakul ki TAGG - azaz aszpirinrezisztenciáról beszélhetünk. Az aszpirin kombinálható egyéb TAGG szerekkel. A dipiridamol + aszpirin kombináció azonban nem csökkentette angioplastica után az akut trombotikus szövődmények előfordulási gyakoriságát az aszpirinnal kezeltekhez képest, és CABG-műtét után nem eredményezte nagyobb graft nyitva maradását. A ticlopidin a stroke-prevencióban hatékonyabb volt az aszpirinnél, egyéb területeken is az aszpirinnel legalábbis egyenértékűnek bizonyult. A clopidogrel előnyösebb volt chr. cardiovascularis megbetegedésekben, mint az aszpirin. A ticlopidin/clopidogrel és aszpirin kombináció a stentimplantációval végzett perkután coronaria-intervenció (PCI) kötelezően alkalmazott, standard kezelése. ACS-ben a clopidogrel és az aszpirin kombinált alkalmazásával az infarktus gyakorisága lényegesen csökkenthető volt a csak aszpirinnel kezelt betegcsoporthoz képest. Fentiek alapján ACS-ben a clopidogrel + aszpirin kombinált adása javasolt.
A teljes thrombocytaaggregáció-gátlás eléréséhez gyakran szükség van a GP IIb/IIIa gátló szerek alkalmazására az aszpirin- vagy a clopidogrel + aszpirin kezelés mellett. A teljes thrombocytaaggregáció-gátlás magas rizikójú betegek kezelése és/vagy PCI végzésekor ajánlható.
Fibrinolitikumok
ST-eleváció nélküli ACS-ben a thrombolyticus kezelés ellenjavallt, mivel e szerek alkalmazása fokozta a halálozást.
| Ajánlás az antiischaemiás kezelésre I. osztályú indikációk - Ágynyugalom, folyamatos EKG-monitorozás (evidenciaszint C).
- Nitroglicerin sublingualisan, majd intravénásan folytatva az ischaemia, ill. azzal kapcsolatos tünetek megszüntetése céljából (evidenciaszint C).
- Oxigénbelégzés cianotikus vagy nehézlégzéses betegnél; cél a 90% feletti oxigénszaturáció biztosítása (evidenciaszint C).
- Ha a fájdalom nitroglicerinre nem szűnik meg azonnal, vagy jelentős pangás, nyugtalanság áll fenn, iv. morfin adása szükséges (evidenciaszint C).
- béta-receptor blokkoló (első adag intravénásan) tartós mellkasi fájdalom esetén, ha nincs kontraindikáció (evidenciaszint B).
- Béta-blokkoló ellenjavallat meglétekor, illetve folyamatosan fennálló vagy visszatérő ischaemia esetén, ha nincs balkamra-diszfunkció, nondihidropiridin kalciumcsatorna-blokkolók (verapamil, diltiazem) adása javasolt (evidenciaszint B).
- ACE-gátló kezelés javasolt, ha nitroglicerin és béta-blokkoló kezelés ellenére a beteg tartósan hipertóniás, valamint ACS és csökkent balkamra-funkció és/vagy szívelégtelenség esetén, ACS és diabetes mellitus együttes fennállásakor (evidenciaszint B).
II/a indikációk - Béta-receptor blokkoló és nitrátkezelés ellenére visszatérő ischaemia esetén hosszú hatású kalciumcsatorna-blokkoló adása javasolt (evidenciaszint C).
- ACE-inhibitor minden betegnek, aki ACS miatt állt kezelés alatt (evidenciaszint B).
- Intraaorticus ballonpumpa-kezelés súlyos, kezelésre rezisztens ischaemia vagy hemodinamikai instabilitás esetén koronarográfia előtt és után (evidenciaszint C).
|
|---|
| Ajánlás az antitrombotikus kezelésre I. osztályú ajánlások - A thrombocytaaggregációt gátló aszpirinkezelést azonnal meg kell kezdeni, és élethosszig folytatni. Aszpirin-túlérzékenység vagy -intolerancia esetén clopidogrel adása indokolt (evidenciaszint: A).
- A kombinált thrombocytaaggregáció-kezelést (aszpirin + clopidogrel) minden esetben legalább egy hónapig kell folytatni (evidenciaszint: A), de ennél hosszabb terápia (9 hónap) is indokolt lehet (evidenciaszint: B).
- Ha perkután intervenciót történt, akkor is az előbbi pontban leírtak érvényesek.
- Ha clopidogrelt szedő betegnél CABG-műtétet tervezünk, a gyógyszert legalább 5, de inkább 7 nappal a műtét előtt le kell állítani (evidenciaszint: B).
- Szubkután LMWH-val vagy intravénás frakcionálatlan heparinnal kiegészítendő a thrombocytaaggregáció-kezelés (lásd előbb).
- Az aszpirin + clopidogrel + heparin kezelés kiegészítendő GP IIb/IIIa blokkolóval, ha PCI-t tervezünk (evidenciaszint: A).
II/a indikációk - Tartósan fennálló ischaemia és magas kockázat esetén az aszpirin + clopidogrel + LMWH/heparin kezelés kiegészítendő eptifibatiddal vagy tirofibannal, akkor is, ha nem tervezünk PCI-t (evidenciaszint: A).
- NSTEMI-ben inkább enoxaparint, mint frakcionálatlan heparint alkalmazzunk, hacsak nem tervezünk CABG-műtétet 24 órán belül (evidenciaszint: A).
- Ha PCI-t tervezünk, akkor GP IIb/IIIa blokkolóval kiegészítendő a heparin + aszpirin + clopidogrel kezelés (evidenciaszint: B).
|
|---|
Antilipaemiás kezelés
Egyre több adat szól amellett, hogy a sztatinkezelés az ACS bármely formájában adva csökkenti a szövődmények kialakulását a lipidszintektől függetlenül.
Revascularisatio
A revascularisatio célja a tartósan fennálló vagy visszatérő myocardialis ischaemia kezelése; a myocardialis infarktushoz vagy halálhoz vezető progresszió megállítása. A revascularisatio indokoltsága esetén a legmegfelelőbb módszer kiválasztása a koronarográfiával kimutatott laesiók kiterjedtségén és jellemzőin múlik.
Koronarográfia
A koronarográfia jelenleg az egyetlen módszer, mellyel klinikailag tisztázni tudjuk a coronariaanatómiát (5). A koronarográfia az anatómiai eltérés jelenlétéről és súlyosságáról tájékoztat. A koronarográfia az egyik alapvető módszer, amelynek segítségével eldönthetjük, hogy van-e a revascularisatiónak indikációja, és ha igen, akkor a revascularisatio milyen módszerrel történjen.
Invazív vs. konzervatív stratégia
A koronarográfia és a revascularisatio szempontjából megkülönböztetünk korai invazív és konzervatív (szelektív invazív) kezelési stratégiát. A korai invazív stratégia esetén a koronarográfia és a revascularisatio igen korán megtörténik (az időpont változó, de mindenképpen a panaszok miatt bekövetkező hospitalizáció során), míg a szelektíven invazív kezelési mód esetén az invazív vizsgálatra/beavatkozásra csak akkor kerül sor, ha a betegnek visszatérő vagy provokálható ischaemiája van.
A korai invazív stratégia alkalmazása esetén több, nagy esetszámú randomizált vizsgálatban jobb eredményeket igazoltak mind a túlélés, mind a szövődmények esetén, mint konzervatív (szelektív invazív) stratégia alkalmazásakor (8, 9). A korai invazív stratégia választása esetén némileg gyakoribb a vérzés és a stroke előfordulása.
Az első ACS miatt történő kórházi felvétel során koronarográfiát és revascularisatiót akkor indokolt végezni, ha ezt a nagy kockázat szükségessé teszi (a kockázat megítélését lásd előbb).
Az alábbi tünetek bármelyike esetén korai invazív stratégia indokolt ACS-ben (I. osztályú indikáció, evidenciaszint A):
- visszatérő ischaemia vagy angina nyugalomban vagy kis terhelésre, intenzív antiischaemiás terápia ellenére;
- emelkedett troponin T vagy troponin I;
- az obszerváció során jelentkező ST-depresszió;
- visszatérő, szívelégtelenséggel, galoppritmussal, tüdőödémával, mitralis regurgitatióval járó ischaemia vagy angina;
- terheléses vizsgálatnál nagy kockázatra utaló jelek;
- csökkent balkamra-funkció (EF<0,4);
- hemodinamikai instabilitás;
- tartós kamrai tachycardia;
- 6 hónapon belüli PCI;
- előző bypassműtét.
Ha nincs kontraindikációja a revascularisatiónak, a fenti tünetek hiánya esetén választható mind a konzervatív, mind pedig az invazív stratégia (I. osztályú indikáció, evidenciaszint B). Azoknál a betegeknél, akiknél ismételten fordul elő ACS a kezelés ellenére, akkor is indokolt a korai invazív stratégia választása, ha nem bizonyított a nagy kockázat, vagy a tartósan fennálló ischaemia igazolható (evidenciaszint C).
Bizonyos esetekben a koronarográfia elvégzése nem javasolt. Az ellenjavallatokat az ACC/AHA ajánlás szerint az alábbiakban foglaljuk össze.
Azon betegcsoportok, akiknél a koronarográfia elvégzése nem javasolt (ACC/AHA III. osztályú indikáció)
- Súlyos társbetegség(ek) jelenléte (pl. máj-, légzési elégtelenség, rák), amikor a revascularisatiós beavatkozás kockázata valószínűleg meghaladja a várható nyereséget.
- Olyan betegeknél, akiknél az akut coronariaszindróma fennállásának valószínűsége csekély, bár heveny mellkasi fájdalmuk volt.
- A koronarográfiát olyan betegeknél sem célszerű elvégezni, akik eleve nem adják beleegyezésüket a revascularisatiós beavatkozáshoz.
Perkután coronaria-intervenció (PCI)
A perkután coronariabeavatkozások biztonsága és sikere ACS-ben lényegesen javult azóta, hogy kiterjedten alkalmazunk stentkezelést és hatékony thrombocytaaggregáció-gátlást (1, 2). A Euroheart Survey adatai szerint ACS-ben a betegeket 25%-ban PCI-vel kezelik, 74%-ban stentet is alkalmaznak, és 27%-ban GP IIb/IIIa receptor gátlók adására is sor kerül. A perkután coronaria-intervenciókra vonatkozólag részletekbe nem bocsátkozunk, utalunk a Kardiológiai Szakmai Kollégium ajánlására.
ACS-ben kiemelendő a stentimplantáció használatának sikere, a glikoprotein IIb/IIIa blokkolók közül mind az abciximab, mind a tirofiban, mind pedig az eptifibatid eredményesnek bizonyult a PCI adjuváns gyógyszeres kezeléseként. PCI után a restenosis aránya még mindig igen magas, de a gyógyszerbevonatú stentek alkalmazásával jelentősen csökkenthető.
| Ajánlások a revascularisatio elvégzésére PCI-vel I. osztályú indikáció - Egy- vagy kétér-betegség, ha nincs proximalis RDA3-szűkület, de nagy a veszélyeztetett életképes myocardium tömege, és a noninvazív vizsgálatok magas kockázatra utalnak (evidenciaszint B).
- Többér-betegségben, ha a coronariaanatómia megfelelő, a balkamra-funkció normális, és diabétesz nem áll fenn (evidenciaszint A).
- ACS miatt végzett PCI esetén intravénás GP IIb/IIIa blokkoló használata indokolt (evidenciaszint A).
II/a osztályú indikációk - Fokális vena saphena graft laesio vagy többszörös vena saphena graft laesio olyan betegeknél, akiknél a reoperáció kockázata fokozott (evidenciaszint C).
- Egy- vagy kétér-betegség esetén RDA-szűkület nélkül, ha a veszélyeztetett myocardium közepes mennyiségű, és ischaemia mutatható ki noninvazív vizsgálatok során (evidenciaszint B).
- Proximalis RDA-betegség (evidenciaszint B).
3RDA = ramus anterior descendens |
|---|
Amennyiben a beteg általános állapota miatt nagy a műtét kockázata, a legfontosabb, arra alkalmas szűkületeken PCI végezhető olyankor is, amikor az ajánlás szerint CABG jönne szóba. Az egyes esetekben bridge-ként szolgál addig az ideig, amíg a CABG elvégzésére sor kerül.
Revascularisatio aortocoronariás bypass graft műtéttel
Az aortocoronariás bypass graft műtét alkalmas az élet meghosszabbítására és a tünetek megszüntetésére számos klinikai-anatómiai tünetegyüttes esetén (6). Akut coronariaszindrómában európai átlagban a betegek 5,4%-a kerül bypassműtétre. Ha lehetőség van az akut tünetek mérséklésére vagy megszüntetésére, akkor érdemes várni a műtét elvégzésével, mert a vizsgálatok adatai szerint az akut állapotban végzett szívsebészeti beavatkozások kockázata nagyobb, mint a tünetek eliminálása a beteg stabilizálása után végzett beavatkozás esetén. A CABG-műtétek egyre nagyobb részét az extrakorporális keringés védelme nélkül, dobogó szíven, „minimálisan invazív” módon végzik. Az ilyen beavatkozások kockázata és a szövődmény gyakorisága - az előzetes közlések szerint - kisebb, mint a szív-tüdő motorral végzett műtéteké. A dobogó szíven és szívmotorral végzett beavatkozások nagy esetszámú, prospektív összehasonlítása még nem történt meg.
| Az aortocoronariás bypassműtét indikációi ACS-ben I. osztályú indikációk - Szignifikáns bal coronaria főtörzs szűkület (evidenciaszint A).
- Háromér-betegség (különösen csökkent balkamra-funkció - EF4<0,50% esetén) (evidenciaszint A).
- A ramus descendens anterior és egy második ér egyidejűleg fennálló proximalis, szignifikáns (>70%) szűkülete, csökkent balkamra-funkció (EF<0,50%) esetén, vagy ha a noninvazív vizsgálatnál ischaemia mutatható ki. (evidenciaszint A).
- Egy- vagy kétér-betegség, ha nincs proximalis RDA-szűkület, de nagy a veszélyeztetett (élőképes) myocardium, és a noninvazív vizsgálatok magas kockázatra utalnak (evidenciaszint B).
II/a osztályú indikációk - Ismételt bypassműtét többszörös vena saphena szűkület esetén - különösen akkor, ha a RDA-t tápláló grafton is van szűkület (evidenciaszint C).
- Egy- vagy kétér-betegség esetén RDA-szűkület nélkül, ha mérsékelt mennyiségű myocardium veszélyeztetett, és ischaemia mutatható ki noninvazív vizsgálatok során (evidenciaszint B).
- Proximalis RDA-betegség (evidenciaszint B).
- Mammaria interna felhasználásával végzett korábbi bypassműtét kezelt cukorbetegségben, többér-betegségben (evidenciaszint B).
4EF = ejekciós frakció |
|---|
Akut állapotban - ha a gyógyszeres kezelés eredménytelen és a PCI kivihetetlen, vagy nem sikeres - sürgős CABG-re lehet szükség. Amennyiben a beteg életminősége - adekvát belgyógyászati kezelés ellenére - nem megfelelő, a panaszok ischaemiás eredetűek, bizonyítottan a koszorúér-szűkület okozza, a perkután intervenció kivihetetlen vagy nem sikeres, akkor a CABG egyér-betegség esetén is elvégezhető.
Diagnosztikus és terápiás algoritmusok
Az ACS miatt kórházba utalt beteg kezelésében az időfaktor rendkívül fontos, ezért indokolt, hogy a kezelését és irányítását végző személyzet részére jól áttekinthető algoritmusok álljanak rendelkezésre. Minden mellkasi fájdalom miatt kórházba került beteg panasza ACS-ként kezelendő, amíg a panaszok más oka nem bizonyítható. A munkadiagnózis megerősítésére az EKG-nak 5 percen belül, a laboratóriumi vizsgálati eredményeknek egy órán belül rendelkezésre kell állniuk. Ezt követően elvégezhető a kockázat felmérése és ennek alapján a további diagnosztikus eljárások elrendelése. A kezdeti kiértékelés lépéseit az első ábra szemlélteti.
1. ábra Az akut coronariaszindróma elsődleges kiértékelésének és a felhasználandó vizsgálatoknak az algoritmusa
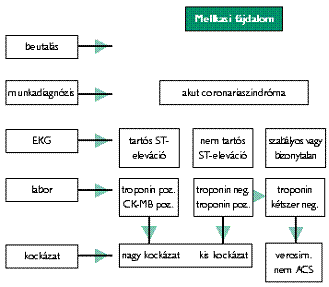
Az algoritmus alkalmazása során kiemelt jelentőséget kell tulajdonítani a gondos anamnézisfelvételnek és a fizikális vizsgálatnak, különösen a billentyűbetegségek, hipertrófiás cardiomyopathia, szívelégtelenség és tüdőbetegségek vonatkozásában.
Az EKG kiértékelésének és a korábbi felvételekkel való összehasonlításnak különösen akkor van jelentősége, ha előzetesen fennálló EKG-eltérések (pl. balkamra-hipertrófia vagy ismert coronariabetegség) állottak fenn. Tartós ST-eleváció esetén a további kezelés a STEMI-ajánlás szerint folytatandó.
A kémiai laboratóriumi meghatározásoknak (hemoglobin, troponin T vagy I, CK-MB) különösen akkor van jelentősége, ha tartós ST-eleváció nem áll fenn, ha az EKG bal Tawara-szár-blokk vagy pacemakerritmus miatt ischaemia szempontjából nehezen értékelhető.
Az EKG-monitorozás mellett szükséges elvégezni az echokardiográfiát is a balkamra-funkció megítélése és egyéb cardiovascularis ok kizárása végett. A fájdalom kezdete után 6-12 órával ismét troponinmeghatározás szükséges, ha az első troponinérték a normális tartományban volt.
2. ábra Stratégiai javaslat algoritmusa az akut coronariaszindróma kezelésére
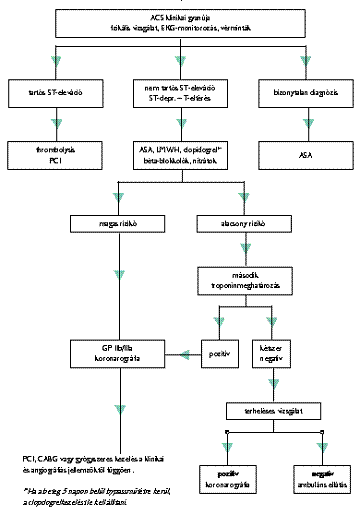
Mindezek után az akut coronariaszindróma myocardialis infarktusra (emelkedett nekrózismarkerek esetén) vagy instabil anginára (EKG-eltérések normális nekrózismarkerek mellett) osztható, és egy kis csoport fennmarad, ahol a diagnózis tisztázására további megfigyelés, ill. vizsgálatok szükségesek.
Ha felállítottuk az ACS diagnózisát, akkor gyógyszeres kezelés (aszpirin, clopidogrel, LMWH vagy frakcionálatlan heparin, béta-receptor blokkolók, orális vagy intravénás nitrátok) folytatható. A kalciumcsatorna-blokkolókat elsősorban a béta-blokkoló kontraindikációja vagy intoleranciája esetén alkalmazzuk.
Ismétlődő mellkasi fájdalom esetén 12 elvezetéses EKG-t kell készíteni és a hemodinamikai helyzetet gondosan monitorozni.
A hosszú távú kockázat kiértékelése alapján nagy és kis kockázatú betegcsoportokat különíthetünk el az alábbi szempontok figyelembevételével.
Szekunder prevenció
Az ACS sikeres kezelése élethosszig tartó szekunder prevenció elkezdésével folytatódik. Definíciószerűen az ACS két hónapig tekinthető instabil állapotnak akkor is, ha a tünetek nem ismétlődnek. A fokozott trombinképződés gyakran az ACS után hat hónapig kimutatható. Invazív beavatkozásra váró betegeknél az LMWH folytatása maximálisan hat hétig előnyösnek mutatkozott.
A rizikófaktorok eliminálásán (dohányzás, étrend, életmód), ill. adekvát kezelésén (diabétesz, hipertónia) kívül a trombotikus kockázat csökkentésére az aszpirinkezelést élethosszig kell folytatni. Elegendő 75-150 mg aszpirin adása. A magasabb dózisok nem eredményeznek nagyobb javulást. Az aszpirin + clopidogrel kombináció folytatása legalább 1 hónapig indokolt, esetleg 9-12 hónapig is hasznos lehet. Az ACS-ben elkezdett és tartósan folytatott lipidcsökkentő (sztatin)kezelés már az első hónapokban hatékony a stroke, az infarktus és a recidiváló angina megelőzésében. Az ACE-gátlók alkalmazásának hasznát ST-eleváció nélküli ACS-t követően eddig még nem lehetett bizonyítani. Az ACE-gátló alkalmazása azonban hasznosnak bizonyult az ACS speciális eseteiben (ACS + csökkent balkamra-funkció, ACS + diabetes mellitus).
A részleteket illetően utalunk a szakmai kollégium prevenciós ajánlására.
Irodalom
1. Braunwald E. et al.: ACC/AHA Guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction. www.acc.org/clinical/guidelines/unstable 2002.
2. Bertrand M. E., Simoons M. L., Fox K. A. A., Wallentin L. C., Hamm C. W., McFadden E., De Feter P. J., Specchia G., Ruzyllo W.: Management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. The Task Force on the Management of Acute Coronary Syndromes of the European Society of Cardiology. Eur Heart J 2002;23, 1809-1840.
3. Myocardial infarction redefined - a consensus document of The Joint European Society of Cardiology/American College of Cardiology Committee for the redefinition of myocardial infarction. J Am Coll Cardiol 2000;36:959-69.
4. Erhardt L., Herlitz J., Bossaert L., Halinen M., Keltai M., Koster R., Marcassa C., Quinn T. and van Weert H.: Task force on the management of chest pain. Eur Heart J 2002;23:1153-1176.
5. Scanlon P. J., Faxon D. P., Audet A. M. et al.: ACC/AHA guidelines for coronary angiography; a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on Coronary Angiography). JACC 1999:33, 1756-1824.
6. Eagle K. A., Guyton R. A., Davidoff R., Ewy G. A., Fonger J., Gardner T. J., Gott J. P., Herrmann H. C., Marlow R. A., Nugent W. C., O’Connor G. T., Orszulak T. A., Rieselbach R. E., Winters W. L., Yusuf S.: ACC/AHA guidelines for coronary artery bypass graft surgery: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee to Revise the 1991 Guidelines for Coronary Artery Bypass Graft Surgery). J. Am. Coll. Cardiol. 34:2162-346, 1999.
7. Guidelines: Acute myocardial infarction: pre-hospital and in-hospital management. The Task Force on the Management of Acute Myocardial Infarction of the European Society of Cardiology. Eur. Heart J. 17:43-63, 1996.
8. Cannon C. P., Weintraub W. S., Demopoulos L. A. et al.: Comparison of early invasive and conservative strategies in patients with unstable coronary syndromes treated with the glycoprotein IIb/IIIa inhibitor tirofiban. N. Engl. J. Med. 2001;344:1879-87.
9. FRISC II investigators: Invasive compared with non-invasive treatment in unstable coronary-artery disease: FRISC II prospective randomised multicentre study. Fragmin and Fast Revascularisation during Instability in Coronary artery disease Investigators. Lancet 1999;354:708-15.





